Last update: 4 augustus 2015
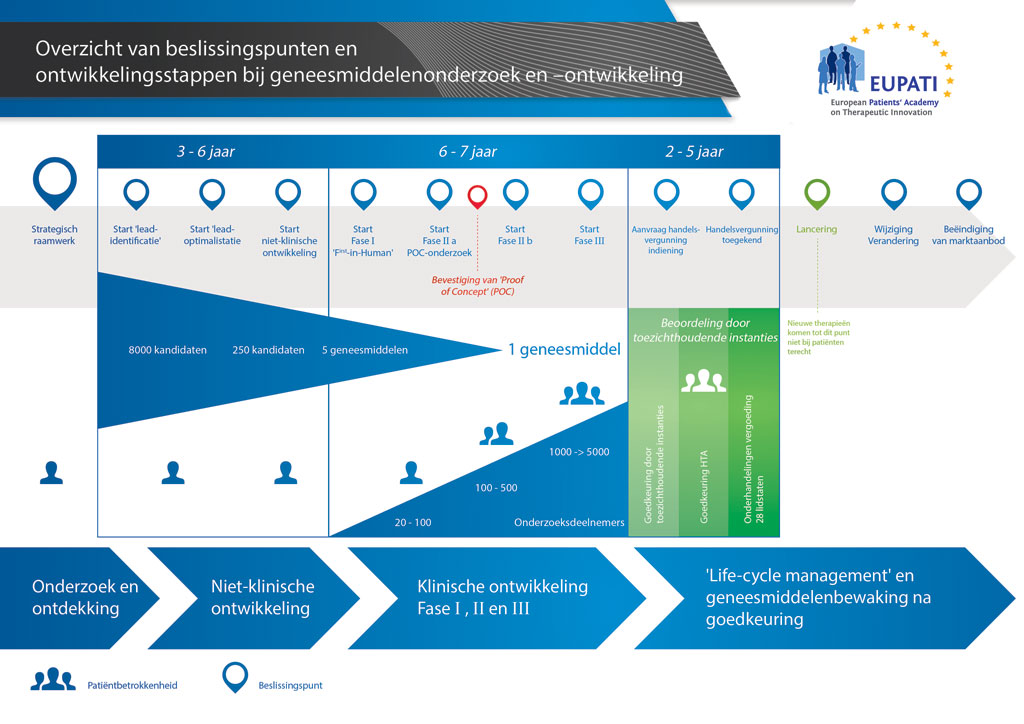
Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt.
Geneesmiddelenontwikkeling is een risicovolle onderneming. De meeste stoffen (ongeveer 98%) die worden ontwikkeld, halen de markt niet als nieuw geneesmiddel. Dit komt voornamelijk doordat de voordelen en risico’s (negatieve bijwerkingen) die tijdens de ontwikkeling worden geconstateerd, zich slechter verhouden tot geneesmiddelen die al verkrijgbaar zijn voor patiënten.
De ontwikkeling van een nieuw geneesmiddel kan worden onderverdeeld in 10 verschillende stappen. Het volgende artikel gaat over Stap 2: Doelwitselectie.
- Er kunnen meer dan 10 jaar aan nauwkeurig plannen en onderzoek nodig zijn om een geneesmiddel te ontwikkelen van een molecuul tot een verkoopbare behandeling.
Wat is een ‘doelwit’?
Ziekten treden op wanneer de normale lichaamsprocessen zijn gewijzigd of niet goed functioneren. Bij de ontwikkeling van een geneesmiddel is het belangrijk om tot in de kleinste details (op het niveau van de moleculen) te begrijpen wat er mis is gegaan. Dit betekent dat de abnormale processen vervolgens als doelwit kunnen worden aangevallen en gecorrigeerd. Het doelwit kan zijn: een molecuul waarvan er te veel zijn aangemaakt, wat de normale lichaamsfunctie verstoort; een molecuul die niet in normale hoeveelheden wordt geproduceerd; of een molecuul die een abnormale structuur heeft. Bijvoorbeeld, bij diabetes is ofwel sprake van te weinig insulineproductie ofwel cellen reageren er niet op, en bij kanker kunnen er teveel chemische boodschappermoleculen zijn die de cellen een signaal geven dat ze abnormaal moeten groeien.
Hoe werkt ‘targeting’?
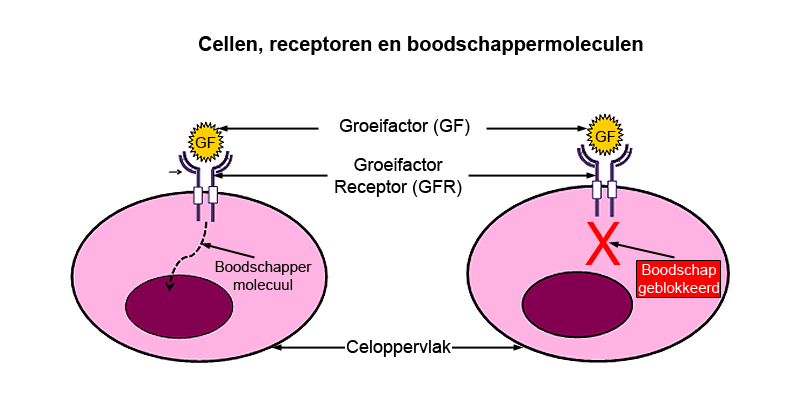
In het figuur hieronder is een eenvoudige voorstelling te zien van een cel met een celkern en een receptor op het celoppervlak.
- De celkern fungeert als het controlecentrum voor de cel – deze bevat het genetische materiaal.
- Dankzij de receptor kunnen chemische boodschappermoleculen communiceren met de celkern.
Wanneer een chemisch boodschappermolecuul, in dit geval de ‘groeifactor’, samengaat met de groeifactorreceptor op het celoppervlak, wordt er een boodschap of signaal gegenereerd in de cel. Dit communiceert vervolgens met de celkern wat de cel aanzet om te delen. Wanneer de signalering ongecontroleerd is, leidt de celgroei tot kanker. Blokkering van de receptor in kankercellen voorkomt overbrenging (of: transmissie) van de boodschap naar de celkern, en voorkomt zodoende ongecontroleerde celgroei.
Als we de receptor in kankercellen kunnen blokkeren, zal dit:
- ervoor zorgen dat de boodschap niet wordt verzonden, en
- ongecontroleerde celgroei voorkomen.
Het doelwit in dit voorbeeld is dan ook de groeifactorreceptor.
- Cellen, receptoren en boodschappers. De groeifactor, een chemische boodschappermolecuul, gaat samen met de groeifactorreceptor op het oppervlak van de cel, waardoor een boodschap wordt verzonden naar de celkern. Blokkering van de receptor voorkomt overdracht van de boodschap en dus ongecontroleerde celgroei. Het ‘doelwit’ in deze voorstelling is de groeifactorreceptor.
Het belang van doelwitselectie
Het is in veel gevallen onmogelijk om in detail te weten wat er mis is gegaan. Vaak zijn er bij een ziekte meerdere afwijkingen, of doelwitten, maar wetenschappers kunnen dan niet precies zeggen welk doelwit verantwoordelijk is voor de ziekte. Het kan ook zijn dat deze afwijkingen de ziekte niet hebben veroorzaakt, en dus zullen pogingen om ze te corrigeren niet leiden tot behandeling van de ziekte. In dat geval richt het ontwikkelingsproject zich misschien wel op het verkeerde doelwit, en zal het uiteindelijk mislukken. Dit betekent dat de selectie van het beste doelwit in een project, essentieel is.
Referenties
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford, UK: Wiley-Blackwell.
Bijlagen
- Factsheet: Geneesmiddelontdekking
Size: 767,640 bytes, Format: .docx
Geneesmiddelontdekking. Dit feitenoverzicht bevat de stappen in het proces van geneesmiddelenontdekking en -ontwikkeling die plaatsvinden voordat een stof kan worden getest bij mensen – van ‘pre-discovery’ (informatie over de ziekte verzamelen) tot niet-klinische veiligheidsproeven met dieren.
- Presentatie: De basisprincipes van geneesmiddelontdekking en -ontwikkeling
Size: 950,426 bytes, Format: .pptx
De basisprincipes van geneesmiddelontdekking en -ontwikkeling. Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt. Deze presentatie gaat nader in op het proces van ontdekking tot marktintroductie van een nieuw geneesmiddel en daarna.
A2-1.02.2-V1.1