Last update: 29 september 2015
Introduktion
Der skal tages forholdsregler, når der skal ordineres lægemidler til særlige populationer, f.eks. børn, ældre, gravide og ammende kvinder samt patienter med nedsat nyre- eller leverfunktion. Mange af disse særlige forholdsregler gennemgås i den offentlige dokumentation af lægemidlet, især produktresuméet og indlægssedlerne.
Produktresumé – information til vejledning af sundhedspersonale og patienter
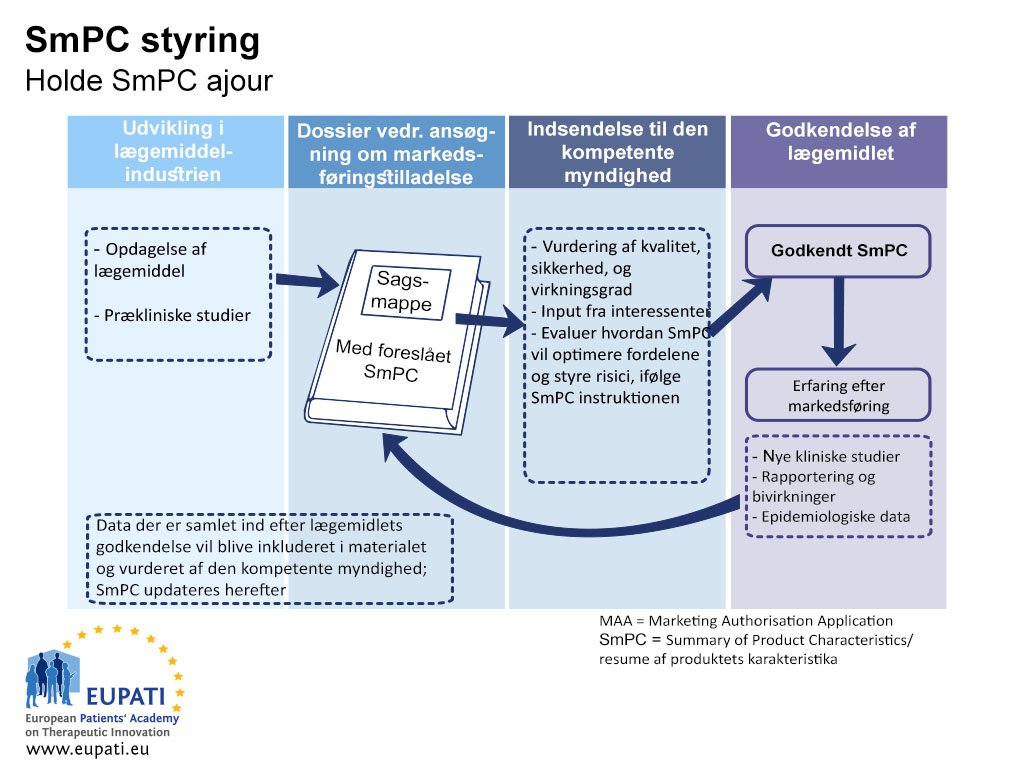
Når en virksomhed søger om en markedsføringstilladelse, indeholder ansøgningsdossieret en beskrivelse til sundhedspersonale af, hvordan lægemidlet bruges sikkert og effektivt. I Europa er dette dokument produktresuméet (SmPC). Produktresuméet skal opdateres gennem et lægemiddels levetid, når der kommer nye data om virkningen eller sikkerheden. Figuren nedenfor viser forholdet mellem udviklingen af et lægemiddel, det regulatoriske dossier med det foreslåede produktresumé, det godkendte produktresumé og det opdaterede produktresumé.
- Resumeer af produktkarakteristika (SmPC) skal holdes opdateret gennem et lægemiddels livscyklus.
Produktresuméet danner også grundlag for udarbejdelsen af indlægssedler, der følger med et lægemiddel, og som indeholder vigtige oplysninger om lægemidlerne til patienterne.
Produktresuméet er i standardformat og indeholder juridisk påkrævet indhold. Det indeholder også et afsnit med kliniske detaljer. Dette afsnit indeholder information om dosen og brugen af lægemidlet:
- i pædiatriske og ældre populationer;
- i patienter med nedsat organfunktion eller andre (samtidige) sygdomme;
- i patienter med en bestemt genotype;
- i patienter, der tilhører en etnisk undergruppe;
- hvor interaktion med andre lægemidler og andre former for interaktion er en faktor; og
- i patienter, der er fødedygtige, gravide eller ammende kvinder.
Dosis
Lægemidlets dosis er en af de vigtigste oplysninger i forhold til særlige populationer, og den er angivet for hver eneste indikation og hver eneste relevante underpopulation.
Børn
Børn er en specifik underpopulation, og det er almindeligt, at lægemidlet bruges på en anden måde i denne gruppe eller i nogle undergrupper af børn. Derfor skal produktresuméet indeholde obligatoriske oplysninger i flere afsnit, hvor den korrekte brug af lægemidlet i børn er beskrevet.
Ældre
Der kan være angivet oplysninger om brug af lægemidlet blandt en ældre population i underafsnit af produktresuméet, hvis der er kendte og klinisk relevante forskelle, f.eks. hvis det er nødvendigt at justere en dosis eller være opmærksom på specifikke risici og metabolisme.
Fødedygtige, gravide og ammende kvinder
Der er angivet oplysninger i produktresuméet om brugen af lægemidlet under graviditet. Der er også anbefalinger om, hvorvidt amningen kan fortsætte, mens lægemidlet indgives.
Hvis der er krav om prævention under og/eller efter behandlingen, bliver denne information angivet sammen med rationalet bag anbefalingen.
Patienter med nedsat nyre- eller leverfunktion
Patienter med nedsat nyre- eller leverfunktion kan kræve justerede doser på grund af potentialet for ændret metabolisme eller ekskretion i forbindelse med lægemidler. Produktresuméet indeholder information om disse mulige dosisjusteringer og om forskellene i lægemidlets farmakokinetiske profil (kroppens virkning på lægemidlet).
Etniske undergrupper
Hvis der er tilgængelige og klinisk relevante oplysninger om lægemidlets specifikke karakteristika i etniske undergrupper, indeholder produktresuméet også disse oplysninger. Der kan være tale om justeringer af indikation eller dosis, kontraindikationer eller andre sikkerhedsoplysninger. Prævalensen af seglcelleanæmi (genetisk blodsygdom) hos patienter af afrikansk afstamning kan f.eks. betyde, at der skal tages særlige forholdsregler, når de tager lægemidlet.
Flere ressourcer
- European Medicines Agency (2013). How to prepare and review a summary of product characteristics. Retrieved 25 August, 2015 from http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000357.jsp&mid=WC0b01ac05806361e1
A2-5.35-v1.1