Last update: 3 Novembre 2020
Autori: Oyiza Momoh, Susan W. Burriss, Anya Harry, Kay Warner
L’importanza dell’inclusione e della diversità negli studi clinici
È fondamentale che i partecipanti agli studi clinici rappresentino fedelmente le varie popolazioni affette dalla malattia secondo le evidenze scientifiche. Tuttavia, ciò non sempre avviene. I pazienti provenienti da contesti diversi spesso non sono inclusi nelle discussioni relative alla pianificazione e progettazione degli studi clinici, come ad esempio la determinazione delle informazioni da raccogliere sulla malattia e sul suo impatto, o le modalità di raccolta di tali informazioni. Ciò può significare che l’onere di partecipare a uno studio clinico per i pazienti è elevato e che essi possono essere scoraggiati dal parteciparvi. Inoltre, se i pazienti che rivedono i piani e i progetti e che partecipano agli studi clinici non provengono da ambienti diversi, i risultati di uno studio potrebbero non essere ampiamente applicabili a tutti i pazienti affetti dalla malattia. Questo può portare a restrizioni nell’etichettatura di un farmaco. Gli operatori sanitari potrebbero ritenere che le informazioni per l’uso stabilite dalle autorità competenti non riflettono la popolazione che intendono trattare e sono quindi incerti su come utilizzare il farmaco.
Ad esempio, immaginiamo quattro soggetti:
- Un uomo indiano di 25 anni, che ama correre regolarmente e vive a Zermatt, in Svizzera.
- Una donna di colore di 50 anni, con una storia familiare di ipertensione arteriosa, che vive a Parigi, in Francia.
- Un uomo bianco di 80 anni, fumatore, con un cancro ai polmoni e residente a Varsavia, in Polonia.
- Una donna asiatica di 40 anni, incinta del suo primo figlio, che vive a Londra, nel Regno Unito.
Queste persone possono rispondere alla terapia, in modo molto diverso a causa di fattori di rischio personali, generalmente classificati nei seguenti gruppi: comportamentali, fisiologici, demografici, ambientali e genetici.
Alcuni fattori che influenzano la salute di un individuo possono cambiare (ad esempio, fattori legati allo stile di vita, come la corsa e il fumo, o fattori ambientali, come il livello di inquinamento a cui siamo esposti). Altri fattori sono quelli non modificabili (ad esempio il sesso biologico, la genetica e l’etnia). Questi fattori ci rendono diversi e sono ulteriormente descritti nella Figura 1. Ulteriori informazioni sui fattori di rischio nella salute e nella malattia sono disponibili nell’articolo EUPATI qui [1].
Classificazione dei fattori intrinseci ed estrinseci
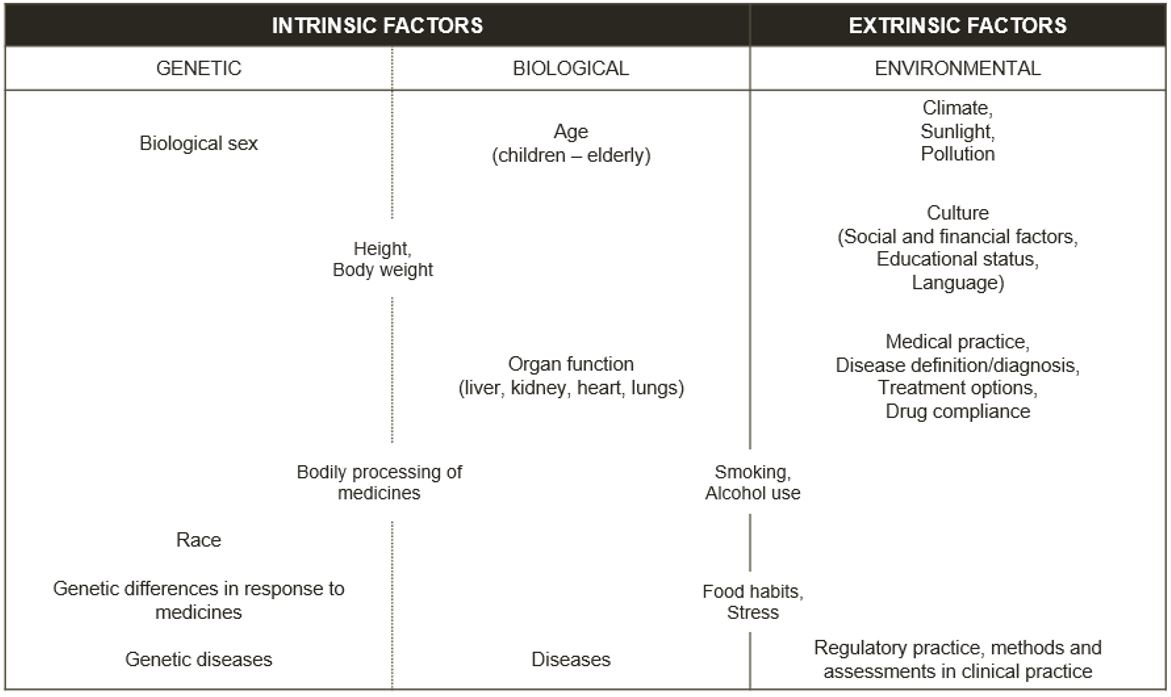
Figura 1 – Standard attuale per la classificazione dei fattori intrinseci ed estrinseci [2]
Gli studi genetici guidano i ricercatori sulle basi biologiche dei potenziali farmaci. La rivista scientifica Nature ha riportato che il 96% dei pazienti inclusi negli studi genetici per la malattia di Alzheimer e il diabete di tipo 2 tra il 2000 e il 2009 erano di origine europea. Nel 2016, l’81% era di origine europea e solo lo 0,08% era di origine araba o mediorientale [3]. Se non ampliamo il coinvolgimento di pazienti appartenenti ad altri gruppi etnici, corriamo il rischio di privarci di conoscenze scientifiche cruciali riguardanti queste malattie e su come ottimizzare lo sviluppo di farmaci per trattare tali patologie. Si può invece pensare che i risultati di un gruppo, in gran parte europeo valgano, per tutte le altre etnie, il che non è sempre vero.
In un censimento del 2011 nel Regno Unito, è emerso che il 14% della popolazione proveniva da comunità di origine nera, asiatica e di minoranza etnica (BAME). Tuttavia, i dati del Regno Unito mostrano che il 34% dei pazienti affetti da coronavirus in condizioni critiche erano provenienti da ambienti BAME [4]. Ciò suggerisce che queste persone sono più colpite dal virus e/o hanno un’esposizione maggiore del previsto e gli studi clinici dovrebbero includerle per capire perché. Purtroppo, gli studi clinici non hanno sempre incluso persone appartenenti a gruppi diversi, come le donne, le persone di età superiore ai 65 anni o le persone di diversa provenienza etnica.
Barriere all’ingresso in studi clinici da parte di partecipanti diversi
La ricerca attuale mostra che esistono barriere comuni alla conduzione di studi clinici in gruppi di persone provenienti da contesti diversi. Sono stati descritti come:
- Mancanza di fiducia nell’industria farmaceutica
-
- Ci possono essere differenze culturali o legate all’età nel modo in cui i pazienti interagiscono con i sistemi sanitari, a causa di casi pregressi di trattamento non etico dei pazienti (ad esempio, lo studio sulla sifilide di Tuskegee, condotto tra il 1932 e il 1972 dal Servizio sanitario pubblico degli Stati Uniti). [5]
- Informazione dei Pazienti sull’argomento Sperimentazione Clinica e le modalità per accedervi
- E’ possibile che i ricercatori non utilizzino una comunicazione efficace con i Pazienti, impedendo così di raggiungere efficacemente coloro che desiderano reclutare per gli studi clinici.
- Le sedi potrebbero essere distanti dai pazienti o potrebbe risultare difficile per questi spostarsi fino ai luoghi in cui si svolgono gli studi clinici.
- I documenti dello studio (ad esempio, i moduli di consenso informato) potrebbero non essere disponibili nelle lingue necessarie o potrebbero essere redatti con una terminologia troppo complessa.
- Selezione e coinvolgimento
- I pazienti provenienti da popolazioni diverse potrebbero non essere disposti a partecipare se le persone che gestiscono il processo di consenso non rappresentano gruppi simili [6].
- Gli sperimentatori potrebbero manifestare pregiudizi quando invitano i partecipanti a prendere parte agli studi clinici [7]. Da un lato, i siti potrebbero tendere a contattare principalmente i propri pazienti di riferimento, i quali potrebbero non rappresentare in modo adeguato una popolazione diversificata. Dall’altro lato, potrebbero non adattare il processo di reclutamento per includere in modo appropriato popolazioni diverse, come ad esempio coinvolgere le famiglie o i gruppi comunitari nel processo di reclutamento [8].
Superare le barriere alla partecipazione alle sperimentazioni cliniche da parte di partecipanti eterogenei
Le comunità e le organizzazioni di pazienti sono fondamentali per trovare soluzioni a queste barriere. Questo obiettivo può essere raggiunto collaborando con i ricercatori per garantire che vengano coinvolti i pazienti più adatti a creare fiducia, a rivedere i materiali e a rappresentare la voce dei pazienti. Gli esempi includono:
- Creare fiducia nell’industria farmaceutica
- Occorre incoraggiare una comunicazione e un impegno più vasto tra tutte le parti interessate per costruire un rapporto di fiducia durevole nel tempo.
- Migliorare la conoscenza da parte dei pazienti riguardo alle sperimentazioni cliniche e l’accesso a queste ultime.
- Le organizzazioni di pazienti che rappresentano ampi gruppi dovrebbero essere coinvolte nella pianificazione delle sperimentazioni cliniche.
- I ricercatori dovrebbero coinvolgere pazienti di diversa provenienza nella revisione del disegno di uno studio clinico e dei documenti associati. In questo modo i ricercatori otterrebbero il contributo delle persone che rappresentano la popolazione target/reale appropriata per lo studio clinico, per aiutare a rispondere a domande importanti (ad esempio, c’è un onere finanziario nel partecipare agli studi clinici? Ci sono siti di studio vicini ai pazienti che rappresentano la popolazione demografica appropriata per la sperimentazione clinica? Sono necessarie ulteriori traduzioni di documenti per renderli comprensibili ai pazienti e facilitare la partecipazione?)
- Selezione e impegno del sito
- I ricercatori potrebbero ricevere consigli sulle barriere dal punto di vista dei pazienti (ad esempio, le esigenze degli over 65 in Europa o nelle comunità minoritarie sono diverse da quelle degli Stati Uniti? Come possono i ricercatori creare connessioni comunitarie con gruppi di persone diverse?).
Conclusioni
La scienza dovrebbe guidare chi partecipa alle sperimentazioni cliniche per garantire che i pazienti vengano arruolati in modo appropriato. Nonostante le barriere, le agenzie regolatorie, i ricercatori e le organizzazioni di pazienti stanno iniziando a concentrarsi sull’inclusione di gruppi diversi di persone negli studi clinici.
- Nel 2016, la Food and Drugs Administration (FDA) statunitense ha descritto le proprie raccomandazioni e aspettative nei confronti delle organizzazioni che conducono studi clinici per la raccolta e la rendicontazione dei dati sull’etnicità ai fini della presentazione delle domande regolatorie [9].
- Nel 2019, un gruppo di aziende farmaceutiche di tutto il mondo (TransCelerate Biopharma) ha introdotto la Patient Experience Initiative, che mira a migliorare il coinvolgimento e la collaborazione tra i pazienti e l’industria.
- Nel 2020, EUPATI Belgio ha pubblicato un’analisi approfondita delle potenziali soluzioni al superamento di tali barriere [10].
In sintesi, migliorare la diversità dei partecipanti alle sperimentazioni cliniche porterà benefici per tutti. Tuttavia, non si tratta di una richiesta semplice, come dimostra l’ultimo Drugs Trials Snapshots della FDA [11]. In presenza di un’elevata incidenza della malattia in un determinato gruppo demografico che rimane sottorappresentato, agli sponsor viene spesso chiesto di effettuare uno studio di impegno post-marketing che aumenta i costi e le tempistiche del programma. Un chiaro esempio di ciò è l’inclusione delle donne negli studi clinici. Gli studi clinici sull’HIV e sulle malattie cardiovascolari non corrispondono ancora alla proporzione di donne partecipanti con la proporzione di donne affette da queste patologie [12]. Il trattamento delle pazienti di sesso femminile basato sui risultati ottenuti sugli uomini potrebbe causare effetti collaterali inaspettati, a causa delle differenze nell’elaborazione della medicina e nell’impatto della malattia sulle persone [13]. Il rischio di comparsa di questi effetti collaterali può essere ridotto se i pazienti appropriati vengono coinvolti negli studi clinici. Pertanto, i dati sulla sicurezza e sull’efficacia dei farmaci in diversi gruppi di persone (ad esempio, per età, sesso ed etnia) possono essere utili ad ampie fasce di popolazione. I dati possono fornire informazioni per aiutare le scelte terapeutiche, mostrando se il farmaco agisce in modo diverso in vari gruppi di persone. Per raggiungere questo obiettivo è necessario superare molte barriere. Ad esempio, i centri di Sperimentazione Clinica possono aver bisogno di sperimentatori principali e di altro personale che rappresenti diversi generi, razze ed etnie. Potrebbero anche aver bisogno di materiali di reclutamento migliori e di una capacità di tradurre i documenti nelle lingue della popolazione di pazienti [14]. Con un maggiore contributo da parte di un gruppo eterogeneo di pazienti, i ricercatori miglioreranno i disegni degli studi clinici e le strategie di reclutamento per ridurre l’onere per i pazienti e garantire che gli studi siano disponibili per coloro che, secondo la scienza, sono i più colpiti dalla malattia. Le discussioni tra gruppi di pazienti, ricercatori e autorità di regolamentazione sono fondamentali per continuare a condividere gli insegnamenti e migliorare il panorama per tutti i pazienti.
La collaborazione continua con la comunità dei pazienti rimane un elemento cruciale per superare le sfide legate alla diversità negli studi clinici. Le partnership tra le organizzazioni dei pazienti e i ricercatori si tradurranno in vantaggi tangibili per la società, avanzando nella missione di fornire farmaci sicuri, efficaci e di alta qualità a tutti i pazienti che ne necessitano.
- EUPATI, 2015. Risk factors in health and disease. https://toolbox.eupati.eu/resources/risk-factors-in-health-and-disease/ [Accessed 4 July 2021]
- Adapted from Guideline, ICH Harmonised Tripartite, 1998. Ethnic factors in the acceptability of foreign clinical data E5 (R1). In International Conference on Harmonisation of technical requirements for registration of pharmaceuticals for human use.
- Popejoy, A.B. and Fullerton, S.M., 2016. Genomics is failing on diversity. Nature News, 538(7624), p.161.
- National Institute for Health Research, 2020. NIHR and UKRI launch call for research on COVID-19 and ethnicity [online]. Available at: https://www.nihr.ac.uk/news/nihr-and-ukri-launch-call-for-research-on-covid-19-and-ethnicity/24658 [Accessed 23 April 2020].
- EUPATI, 2015. https://toolbox.eupati.eu/resources/ethics-in-human-medical-research/
- Society for Clinical Research, 2018, Recruiting Diverse Patient Populations in Clinical Studies: Factors That Drive Site Success.
- Clark, L.T., Watkins, L., Piña, I.L., Elmer, M., Akinboboye, O., Gorham, M., Jamerson, B., McCullough, C., Pierre, C., Polis, A.B. and Puckrein, G., 2019. Increasing diversity in clinical trials: overcoming critical barriers. Current problems in cardiology, 44(5), pp.148-172.
- George, S., Duran, N. and Norris, K., 2014. A systematic review of barriers and facilitators to minority research participation among African Americans, Latinos, Asian Americans, and Pacific Islanders. American journal of public health, 104(2), pp.e16-e31.
- Food and Drug Administration, 2016. Collection of race and ethnicity data in clinical trials. Guidance for Industry and Food and Drug Administration Staff https://www.fda.gov/regulatory-information/search-fda-guidance-documents/collection-race-and-ethnicity-data-clinical-trials [Accessed 15 May 2020].
- Grine, L., Janssens, R., van Overbeeke, E., Derijcke, D., Silva, M., Delys, B., Dusart, I., Aertsen, V., Mertens de Wilmars, M., Robaczewska, J. and Stevens, H., 2020. Improving Patient Involvement in the Lifecycle of Medicines: Insights From the EUPATI BE Survey. Frontiers in Medicine
- US Food and Drug Administration, 2019. Drug Trials Snapshots Summary Report. https://www.fda.gov/media/135337/download [Accessed 12 October 2020].
- Feldman, S., Ammar, W., Lo, K., Trepman, E., van Zuylen, M. and Etzioni, O., 2019. Quantifying sex bias in clinical studies at scale with automated data extraction. JAMA network open, 2(7), pp.e196700-e196700.
- Wallach, J.D., Sullivan, P.G., Trepanowski, J.F., Steyerberg, E.W. and Ioannidis, J.P., 2016. Sex based subgroup differences in randomized controlled trials: empirical evidence from Cochrane meta-analyses. BMJ, 355.
- Oh, S.S., Galanter, J., Thakur, N., Pino-Yanes, M., Barcelo, N.E., White, M.J., de Bruin, D.M., Greenblatt, R.M., Bibbins-Domingo, K., Wu, A.H. and Borrell, L.N., 2015. Diversity in clinical and biomedical research: a promise yet to be fulfilled. PLoS medicine, 12(12), p.e1001918.


