Last update: 3 Νοεμβρίου 2020
Συγγραφείς: Oyiza Momoh, Susan W. Burriss, Anya Harry, Kay Warner
Η σημασία της συμπερίληψης και της διαφορετικότητας στις κλινικές δοκιμές.
Είναι σημαντικό τα άτομα που συμμετέχουν σε κλινικές δοκιμές να αντιπροσωπεύουν πραγματικά τους πληθυσμούς που, σύμφωνα με τα επιστημονικά στοιχεία, επηρεάζονται από την ασθένεια. Αυτό δεν συμβαίνει πάντα. Οι ασθενείς με διαφορετικό υπόβαθρο δεν συμμετέχουν πάντα στις συζητήσεις σχετικά με τα σχέδια και τον σχεδιασμό των κλινικών δοκιμών (π.χ. ποιες πληροφορίες πρέπει να συλλέγονται σχετικά με την ασθένεια και πώς τους επηρεάζει ή πώς συλλέγονται οι πληροφορίες). Αυτό μπορεί να σημαίνει ότι η επιβάρυνση των ασθενών από τη συμμετοχή σε μια κλινική δοκιμή είναι μεγάλη και μπορεί να τους αποθαρρύνει από τη συμμετοχή. Επιπλέον, εάν οι ασθενείς που εξετάζουν τα σχέδια, τους σχεδιασμούς και συμμετέχουν στις κλινικές δοκιμές δεν έχουν διαφορετικό υπόβαθρο, τα αποτελέσματα μιας δοκιμής μπορεί να μην έχουν ευρεία εφαρμογή σε όλους τους πάσχοντες από την ασθένεια. Αυτό μπορεί να οδηγήσει σε περιορισμούς στην επισήμανση ενός φαρμάκου. Οι επαγγελματίες υγείας μπορεί να θεωρούν ότι οι οδηγίες χρήσης που καθορίζονται από τις αρμόδιες αρχές δεν αντιπροσωπεύουν τον πληθυσμό που επιθυμούν να θεραπεύσουν και, ως εκ τούτου, δεν είναι σίγουροι για τον τρόπο χρήσης του φαρμάκου.
Για παράδειγμα, φανταστείτε τέσσερα άτομα:
- Ένας 25χρονος, Ινδός, άνδρας, που του αρέσει να τρέχει τακτικά και ζει στο Ζέρματ της Ελβετίας.
- Μια 50χρονη, μαύρη γυναίκα, η οποία έχει οικογενειακό ιστορικό υψηλής αρτηριακής πίεσης και ζει στο Παρίσι, Γαλλία.
- Ένας 80χρονος, λευκός άνδρας που καπνίζει, έχει καρκίνο του πνεύμονα και ζει στη Βαρσοβία της Πολωνίας.
- Μια 40χρονη, Ασιάτισσα, γυναίκα, η οποία είναι έγκυος στο πρώτο της μωρό και ζει στο Λονδίνο, Ηνωμένο Βασίλειο.
Τα άτομα αυτά μπορεί να ανταποκρίνονται στα φάρμακα πολύ διαφορετικά λόγω προσωπικών παραγόντων κινδύνου, οι οποίοι γενικά κατηγοριοποιούνται στις ακόλουθες κατηγορίες: συμπεριφορικοί, φυσιολογικοί, δημογραφικοί, περιβαλλοντικοί και γενετικοί.
Ορισμένοι παράγοντες που επηρεάζουν την υγεία ενός ατόμου μπορούν να μεταβληθούν (π.χ. παράγοντες του τρόπου ζωής, όπως το τρέξιμο και το κάπνισμα, ή περιβαλλοντικοί παράγοντες, όπως το επίπεδο ρύπανσης στο οποίο είμαστε εκτεθειμένοι). Άλλοι παράγοντες είναι αυτοί που δεν μπορούμε να αλλάξουμε (π.χ. το βιολογικό φύλο, τα γενετικά στοιχεία και η εθνικότητα). Αυτοί οι παράγοντες μας καθιστούν διαφορετικούς και περιγράφονται περαιτέρω στην Εικόνα 1. Περισσότερες πληροφορίες σχετικά με τους παράγοντες κινδύνου στην υγεία και την ασθένεια μπορείτε να βρείτε στο άρθρο της EUPATI εδώ {1}.
Ταξινόμηση εγγενών και εξωγενών παραγόντων
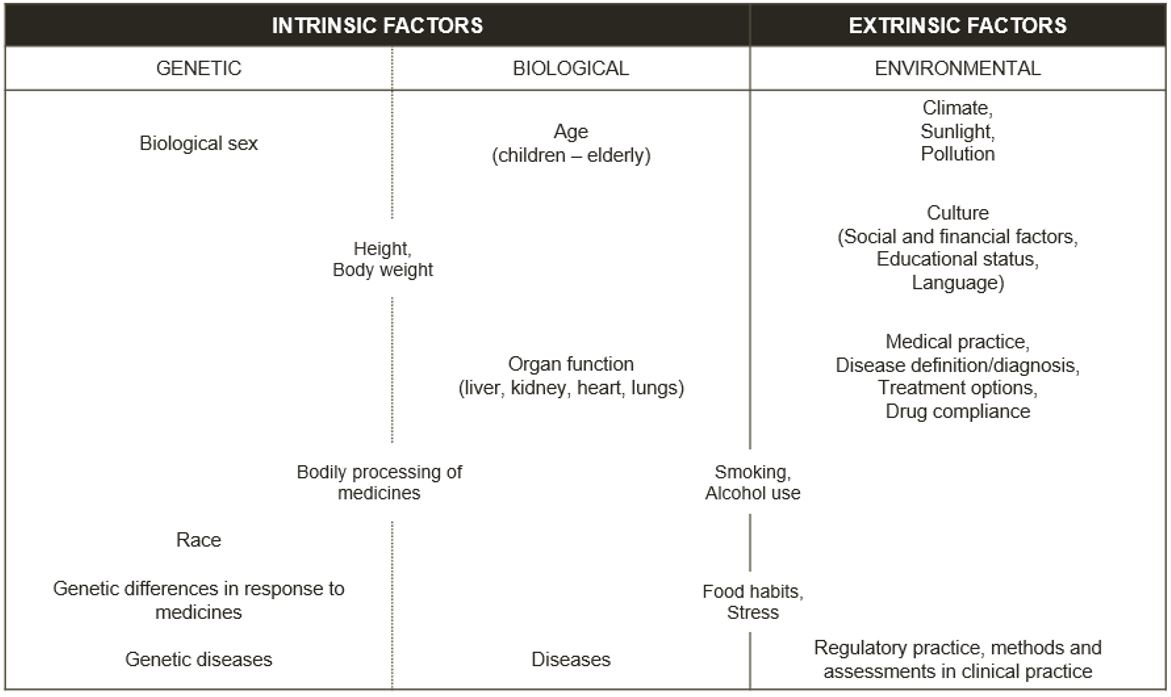
Εικόνα 1 – Ισχύον πρότυπο για την ταξινόμηση εγγενών και εξωγενών παραγόντων {2}
Οι γενετικές μελέτες καθοδηγούν τους ερευνητές στη βιολογική βάση των δυνητικών φαρμάκων. Το επιστημονικό περιοδικό Nature ανέφερε ότι το 96% των ασθενών που συμμετείχαν σε γενετικές μελέτες για τη νόσο Αλτσχάιμερ και τον διαβήτη τύπου 2 μεταξύ 2000 και 2009 ήταν ευρωπαϊκής καταγωγής. Μέχρι το 2016, το 81% ήταν ευρωπαϊκής καταγωγής, αλλά μόνο το 0,08% ήταν αραβικής ή μεσανατολικής καταγωγής {3}. Σε περίπτωση μη συμμετοχής περισσότερων ασθενών από άλλες εθνοτικές ομάδες, μπορεί να χάσουμε τη δυνατότητα συλλογής κρίσιμων πληροφοριών μέσω της επιστήμης σχετικά με αυτές τις ασθένειες και τον καλύτερο τρόπο ανάπτυξης φαρμάκων γι’ αυτές. Αντίθετα, μπορεί να σκεφτούμε ότι τα αποτελέσματα από μια κατά βάση ευρωπαϊκή ομάδα ισχύουν για όλες τις άλλες εθνότητες, κάτι που δεν ισχύει πάντα.
Στο Ηνωμένο Βασίλειο, η απογραφή του 2011 έδειξε ότι το 14% των ατόμων ανήκαν σε Μαύρους, Ασιάτες και εθνοτικές μειονότητες (BAME). Ωστόσο, τα στοιχεία του Ηνωμένου Βασιλείου δείχνουν ότι το 34% των ασθενών που νοσούν από κορονοϊό σε κρίσιμη κατάσταση προέρχονται από το υπόβαθρο της BAME {4}. Αυτό υποδηλώνει ότι τα άτομα αυτά επηρεάζονται περισσότερο από τον ιό ή/και έχουν μεγαλύτερη έκθεση από την αναμενόμενη και οι κλινικές δοκιμές θα πρέπει να τα συμπεριλάβουν για να κατανοήσουν το γιατί. Δυστυχώς, οι κλινικές δοκιμές δεν συμπεριλαμβάνουν πάντοτε άτομα από διαφορετικές ομάδες, όπως γυναίκες, άτομα άνω των 65 ετών ή άτομα από διαφορετικές εθνότητες.
Εμπόδια στη συμμετοχή σε κλινικές δοκιμές από διαφορετικούς συμμετέχοντες
Η τρέχουσα έρευνα δείχνει ότι υπάρχουν κοινά εμπόδια στη διεξαγωγή κλινικών δοκιμών σε διάφορες ομάδες ατόμων. Έχουν περιγραφεί ως:
- Έλλειψη εμπιστοσύνης στη φαρμακευτική βιομηχανία
-
- Ενδέχεται να υπάρχουν πολιτισμικές ή ηλικιακές διαφορές στον τρόπο με τον οποίο οι ασθενείς αλληλεπιδρούν με τα συστήματα υγειονομικής περίθαλψης λόγω παλαιότερων περιπτώσεων ανήθικης μεταχείρισης ασθενών (π.χ. η μελέτη Tuskegee Syphilis Study, που διεξήχθη μεταξύ 1932 και 1972 από τις ΗΠΑ). [5]
- Ενημέρωση των ασθενών για τις κλινικές δοκιμές και την πρόσβαση σε αυτές
- Οι ερευνητές μπορεί να μην χρησιμοποιούν τον κατάλληλο τρόπο επικοινωνίας για να προσεγγίσουν τους ασθενείς που θέλουν να συμμετάσχουν στις κλινικές δοκιμές.
- Τα κέντρα μελέτης ενδέχεται να μην βρίσκονται στον τόπο διαμονής των ασθενών ή οι ασθενείς ενδέχεται να μην μπορούν να ταξιδέψουν στα μέρη όπου διεξάγονται οι κλινικές δοκιμές.
- Τα έγγραφα της δοκιμής (π.χ. έντυπα συγκατάθεσης κατόπιν ενημέρωσης) ενδέχεται να μην είναι διαθέσιμα στις απαραίτητες γλώσσες ή να έχουν συνταχθεί με πολύπλοκους όρους.
- Επιλογή κέντρου μελέτης και συμμετοχή
- Ασθενείς από διαφορετικούς πληθυσμούς μπορεί να μην είναι πρόθυμοι να συμμετάσχουν, εάν τα άτομα που διαχειρίζονται τη διαδικασία συναίνεσης δεν εκπροσωπούν παρόμοιες ομάδες {6}.
- Μπορεί επίσης να υπάρχει μεροληψία του ερευνητή όταν ζητείται από τους συμμετέχοντες να λάβουν μέρος σε κλινικές δοκιμές {7}. Από τη μία πλευρά, τα κέντρα μελετών είναι πιο πιθανό να επικοινωνήσουν με την υπάρχουσα δεξαμενή ασθενών τους, η οποία μπορεί να μην αντιπροσωπεύει έναν ποικιλόμορφο πληθυσμό. Από την άλλη πλευρά, μπορεί να μην προσαρμόζουν τη διαδικασία πρόσληψής τους ώστε να συμπεριλαμβάνει διαφορετικούς πληθυσμούς (π.χ. συμμετοχή οικογενειών ή κοινοτικών ομάδων στη διαδικασία πρόσληψης) [8].
Υπέρβαση των εμποδίων στη συμμετοχή σε κλινικές δοκιμές από διαφορετικούς συμμετέχοντες
Οι κοινότητες και οι οργανώσεις ασθενών είναι ζωτικής σημασίας για την εξάλειψη των εν λόγω εμποδίων. Αυτό μπορεί να επιτευχθεί μέσω της συνεργασίας με τους ερευνητές, ώστε να διασφαλιστεί η συμμετοχή των καταλληλότερων ασθενών για την οικοδόμηση εμπιστοσύνης, την επισκόπηση του υλικού και την εκπροσώπηση της άποψης των ασθενών. Τα παραδείγματα περιλαμβάνουν:
- Οικοδόμηση εμπιστοσύνης στη φαρμακευτική βιομηχανία
- Θα πρέπει να ενθαρρυνθεί η πιο ανοικτή επικοινωνία και η συμμετοχή όλων των ενδιαφερομένων μερών ώστε να οικοδομηθεί η εμπιστοσύνη με την πάροδο του χρόνου.
- Βελτίωση της ενημέρωσης των ασθενών σχετικά με τις κλινικές δοκιμές και την πρόσβαση σε αυτές.
- Οι οργανώσεις ασθενών που εκπροσωπούν ευρείες ομάδες πρέπει να συμμετέχουν στον σχεδιασμό των κλινικών δοκιμών.
- Οι ερευνητές πρέπει να χρησιμοποιούν ασθενείς με διαφορετικό υπόβαθρο στην εξέταση του σχεδιασμού κλινικών δοκιμών και των σχετικών εγγράφων. Αυτό θα διασφαλίσει για τους ερευνητές ότι λαμβάνουν πληροφορίες από άτομα που αντιπροσωπεύουν τον κατάλληλο πληθυσμό-στόχο/πραγματικό πληθυσμό για την κλινική δοκιμή προκειμένου να απαντηθούν σημαντικά ερωτήματα (π.χ. υπάρχει οικονομική επιβάρυνση για τη συμμετοχή σε κλινικές δοκιμές; Υπάρχουν κέντρα μελέτης κοντά στους ασθενείς που αντιπροσωπεύουν τον κατάλληλο δημογραφικό πληθυσμό για την κλινική δοκιμή; Χρειάζονται πρόσθετες μεταφράσεις των εγγράφων για να γίνουν κατανοητά από τους ασθενείς και να διευκολυνθεί η συμμετοχή τους;).
- Επιλογή κέντρου μελέτης και συμμετοχή
- Οι ερευνητές θα μπορούσαν να ενημερωθούν σχετικά με τα εμπόδια από τη σκοπιά των ασθενών (π.χ. οι ανάγκες των ατόμων άνω των 65 ετών στην Ευρώπη ή σε μειονοτικές κοινότητες είναι διαφορετικές από τις αυτές των αντίστοιχων ατόμων στις ΗΠΑ;)
Συμπέρασμα
Η επιστήμη θα πρέπει να καθορίζει ποιος συμμετέχει σε κλινικές δοκιμές, ώστε να διασφαλίζεται ότι μελετώνται οι κατάλληλοι ασθενείς. Παρά τα εμπόδια, οι ρυθμιστικές αρχές, οι ερευνητές και οι οργανώσεις ασθενών αρχίζουν να εστιάζουν στη συμμετοχή διαφορετικών ομάδων ατόμων στις κλινικές δοκιμές.
- Το 2016, η Υπηρεσία Ελέγχου Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) περιέγραψε τις συστάσεις και τις προσδοκίες του αναφορικά με τις οργανώσεις που διεξάγουν κλινικές δοκιμές για τη συλλογή και αναφορά δεδομένων εθνοτικότητας στο πλαίσιο της υποβολής αιτήσεων για έγκριση από τις ρυθμιστικές αρχές {9}.
- Το 2019, μια ομάδα φαρμακευτικών εταιρειών από όλο τον κόσμο (TransCelerate Biopharma) παρουσίασε την Πρωτοβουλία για την Εμπειρία των Ασθενών (Patient Experience Initiative), η οποία αποσκοπεί στη βελτίωση της συμμετοχής και της συνεργασίας μεταξύ των ασθενών και της φαρμακοβιομηχανίας.
- Το 2020, η EUPATI Belgium δημοσίευσε μια εμπεριστατωμένη επισκόπηση των πιθανών λύσεων για την αντιμετώπιση αυτών των εμποδίων [10].
Με απλά λόγια, η βελτίωση του επιπέδου διαφορετικότητας των συμμετεχόντων στις κλινικές δοκιμές θα ωφελήσει όλους. Ωστόσο, δεν πρόκειται για μια απλή διαδικασία, όπως αποδεικνύεται από τα τελευταία στιγμιότυπα των δοκιμών φαρμάκων της Υπηρεσίας [11]. Όταν υπάρχει υψηλή επιβάρυνση από ασθένειες σε μια δεδομένη δημογραφική ομάδα που παραμένει υποεκπροσωπούμενη, οι χορηγοί συχνά καλούνται να πραγματοποιήσουν μια μελέτη δέσμευσης μετά την κυκλοφορία στην αγορά, η οποία αυξάνει το κόστος και το χρονοδιάγραμμα του προγράμματος. Ένα σαφές παράδειγμα αυτού είναι η ένταξη των γυναικών σε κλινικές δοκιμές. Σε κλινικές δοκιμές για τον HIV και το καρδιαγγειακό σύστημα εξακολουθεί να μην αντιστοιχεί το ποσοστό των γυναικών συμμετεχόντων με το ποσοστό των γυναικών με αυτές τις παθήσεις [12]. Η θεραπεία των γυναικών ασθενών με βάση τα αποτελέσματα των ανδρών μπορεί να οδηγήσει σε απροσδόκητες παρενέργειες λόγω των διαφορών στον τρόπο με τον οποίο οι άνθρωποι επεξεργάζονται τα φάρμακα και τον τρόπο με τον οποίο οι ασθένειες τους επηρεάζουν [13]. Ο κίνδυνος εμφάνισης αυτών των ανεπιθύμητων ενεργειών μπορεί να μειωθεί εάν οι κατάλληλοι ασθενείς συμμετέχουν σε κλινικές δοκιμές. Ως εκ τούτου, τα δεδομένα σχετικά με την ασφάλεια και την αποτελεσματικότητα των φαρμάκων σε διάφορες ομάδες ατόμων (π.χ. ανά ηλικία, φύλο και εθνικότητα) μπορούν να ωφελήσουν ευρύτερους πληθυσμούς. Τα δεδομένα μπορούν να παράσχουν πληροφορίες που θα βοηθήσουν στη λήψη θεραπευτικών αποφάσεων, δείχνοντας αν το φάρμακο δρα διαφορετικά σε διάφορες ομάδες ατόμων. Για να επιτευχθεί αυτό πρέπει να ξεπεραστούν πολλά εμπόδια. Για παράδειγμα, τα κέντρα μελέτης μπορεί να χρειάζονται κύριους ερευνητές και άλλο προσωπικό που να αντιπροσωπεύει διαφορετικά φύλα, φυλετικές και εθνοτικές καταβολές. Μπορεί επίσης να χρειάζονται βελτιωμένο υλικό πρόσληψης και δυνατότητα μετάφρασης των εγγράφων στις γλώσσες του πληθυσμού των ασθενών [14]. Με την αυξημένη συμβολή μιας ποικιλόμορφης ομάδας ασθενών, οι ερευνητές θα βελτιώσουν τα σχέδια κλινικών δοκιμών και τις στρατηγικές πρόσληψης για να μειώσουν την επιβάρυνση των ασθενών και να διασφαλίσουν ότι οι δοκιμές θα είναι διαθέσιμες σε εκείνους που, σύμφωνα με την επιστήμη, επηρεάζονται περισσότερο από την ασθένεια. Οι συζητήσεις μεταξύ ομάδων ασθενών, ερευνητών και ρυθμιστικών αρχών είναι ζωτικής σημασίας για τη συνεχή ανταλλαγή διδακτικών εμπειριών και τη βελτίωση των συνθηκών για όλους τους ασθενείς.
Η κοινότητα των ασθενών εξακολουθεί να αποτελεί έναν σημαντικό εταίρο στην αντιμετώπιση των εμποδίων σχετικά με την ποικιλομορφία των κλινικών δοκιμών. Η συνεργασία των οργανώσεων ασθενών με τους ερευνητές θα ωφελήσει τελικά την κοινωνία στο πλαίσιο της αποστολής για τη λήψη ασφαλών, αποτελεσματικών και υψηλής ποιότητας φαρμάκων σε όλους τους ασθενείς που τα χρειάζονται.
- EUPATI, 2015. Risk factors in health and disease. https://toolbox.eupati.eu/resources/risk-factors-in-health-and-disease/ [Accessed 4 July 2021]
- Adapted from Guideline, ICH Harmonised Tripartite, 1998. Ethnic factors in the acceptability of foreign clinical data E5 (R1). In International Conference on Harmonisation of technical requirements for registration of pharmaceuticals for human use.
- Popejoy, A.B. and Fullerton, S.M., 2016. Genomics is failing on diversity. Nature News, 538(7624), p.161.
- National Institute for Health Research, 2020. NIHR and UKRI launch call for research on COVID-19 and ethnicity [online]. Available at: https://www.nihr.ac.uk/news/nihr-and-ukri-launch-call-for-research-on-covid-19-and-ethnicity/24658 [Accessed 23 April 2020].
- EUPATI, 2015. https://toolbox.eupati.eu/resources/ethics-in-human-medical-research/
- Society for Clinical Research, 2018, Recruiting Diverse Patient Populations in Clinical Studies: Factors That Drive Site Success.
- Clark, L.T., Watkins, L., Piña, I.L., Elmer, M., Akinboboye, O., Gorham, M., Jamerson, B., McCullough, C., Pierre, C., Polis, A.B. and Puckrein, G., 2019. Increasing diversity in clinical trials: overcoming critical barriers. Current problems in cardiology, 44(5), pp.148-172.
- George, S., Duran, N. and Norris, K., 2014. A systematic review of barriers and facilitators to minority research participation among African Americans, Latinos, Asian Americans, and Pacific Islanders. American journal of public health, 104(2), pp.e16-e31.
- Food and Drug Administration, 2016. Collection of race and ethnicity data in clinical trials. Guidance for Industry and Food and Drug Administration Staff https://www.fda.gov/regulatory-information/search-fda-guidance-documents/collection-race-and-ethnicity-data-clinical-trials [Accessed 15 May 2020].
- Grine, L., Janssens, R., van Overbeeke, E., Derijcke, D., Silva, M., Delys, B., Dusart, I., Aertsen, V., Mertens de Wilmars, M., Robaczewska, J. and Stevens, H., 2020. Improving Patient Involvement in the Lifecycle of Medicines: Insights From the EUPATI BE Survey. Frontiers in Medicine
- US Food and Drug Administration, 2019. Drug Trials Snapshots Summary Report. https://www.fda.gov/media/135337/download [Accessed 12 October 2020].
- Feldman, S., Ammar, W., Lo, K., Trepman, E., van Zuylen, M. and Etzioni, O., 2019. Quantifying sex bias in clinical studies at scale with automated data extraction. JAMA network open, 2(7), pp.e196700-e196700.
- Wallach, J.D., Sullivan, P.G., Trepanowski, J.F., Steyerberg, E.W. and Ioannidis, J.P., 2016. Sex based subgroup differences in randomized controlled trials: empirical evidence from Cochrane meta-analyses. BMJ, 355.
- Oh, S.S., Galanter, J., Thakur, N., Pino-Yanes, M., Barcelo, N.E., White, M.J., de Bruin, D.M., Greenblatt, R.M., Bibbins-Domingo, K., Wu, A.H. and Borrell, L.N., 2015. Diversity in clinical and biomedical research: a promise yet to be fulfilled. PLoS medicine, 12(12), p.e1001918.


