Last update: 19 ноября 2015
Введение
С помощью клинических испытаний создаются новые медицинские препараты и совершенствуются уже доступные пациентам способы лечения. Информация относительно результативности и безопасности таких способов лечения, получаемая в ходе клинических испытаний, важна, поскольку позволяет пациентам и их врачам принимать информированные решения о лечении. Целесообразность лечения необходимо оценивать в глобальном масштабе с учетом всех результатов клинических исследований, проводимых по этому виду лечения. Доступ к информации о клинических испытаниях — это одно из важнейших средств повышения результативности научных исследований, которое снижает дублирование или повторение научных изысканий. Прозрачность информации о клинических испытаниях важна для обеспечения доверия к результатам клинического исследования. Читателю необходимо критически подходить к публикуемой информации о клинических испытаниях.
Что представляют собой результаты клинического исследования?
Результаты клинического исследования или испытания включают в себя все полученные в его рамках данные, оценки и итоги статистических анализов.
Результаты исследования включают следующие элементы:
- Описание исследуемой категории пациентов Количество участников по каждому исследуемому виду лечения, которые начала, завершили и прекратили свое участие в исследовании.
- Исходные данные: Данные, собранные в начале клинического исследования. Эти данные включают в себя: демографические характеристики (например, пол и возраст), антропометрические измерения пациентов (например, рост, вес, артериальное давление и т. д.) и связанные с исследованием параметры (например, особенности заболевания или предшествующего лечения).
- Параметры для измерения воздействия лечения на пациентов: Например, действие медицинского препарата во время испытания 2 фазы и (или) качество жизни во время испытаний 3 фазы.
- Нежелательные побочные эффекты, которые испытывают участники исследований: например, боль, тошнота и прочие побочные эффекты.
Отчет о клиническом исследовании (Clinical Study Report, CSR) — это официальный документ, в котором описываются результаты клинического исследования и предоставляются подтверждающие данные о возможности его медицинского применения для людей. Отчет о клиническом исследовании составляется по форме, предусмотренной контрольно-надзорными органами. Отчет составляется спонсором исследования и включается в качестве составной части в Общий технический документ (Common Technical Document, CTD). В связи с вопросами конфиденциальности и коммерческой тайны доступ к отчетам о клинических исследованиях обычно имеют только спонсор и контрольно-надзорные органы, которые осуществляют рассмотрение заявки на получение регистрационного свидетельства.
Публикация результатов клинического исследования
После окончания клинических исследований и анализов исследователи могут делиться своими выводами на научных конференциях и в медицинских периодических изданиях. Перед опубликованием материала в медицинской периодике работа отправляется на экспертную оценку независимым специалистам по выбору редактора издания.
Опубликованный материал должен быть достаточно подробным для того, чтобы читатель мог вынести свое собственное суждение о результатах исследования. Уверенность, которая появляется у читателя относительно истинности полученных результатов, зависит от качества публикации. В этой связи для составления отчетности в стандартном виде существуют инструкции и контрольные списки, которые различаются в зависимости от вида проводимого исследования.
В настоящее время различные организации предпринимают активные действия по продвижению или требованию регистрации и раскрытия информации о клинических испытаниях. Информация обо всех клинических испытаниях над медицинскими препаратами, проведенных в Европе, заносится в Европейскую базу данных клинических испытаний (EudraCT) Европейского агентства по лекарственным средствам (EMA). По состоянию на июль 2014 года эта база данных была доступна широкой общественности, предоставляя общие результаты испытаний. Результаты испытаний, которые проводятся в ЕС после 1 января 2015 года, вне зависимости от положительных или отрицательных заключений, подлежат опубликованию. Всемирная организация здравоохранения устанавливает международные стандарты регистрации и отчетности для всех клинических испытаний через принадлежащую ей Международную платформу реестров клинических испытаний (International Clinical Trials Registry Platform, ICTRP). В США аналогичным образом функционирует реестр www.clinicaltrials.gov.
Уровни подтверждающих данных в результатах клинического исследования
Решения о медицинском лечении сейчас чаще всего принимаются на основе доказательной медицины. Доказательная медицина сочетает клинический опыт с текущими лучшими подтверждающими данными, полученными в ходе контролируемых исследований и научных работ с целью подобрать для пациента оптимальный вариант лечения. Информация относительно результативности и безопасности лечения важна для доказательной медицины, позволяя пациентам и их врачам принимать информированные решения о лечении.
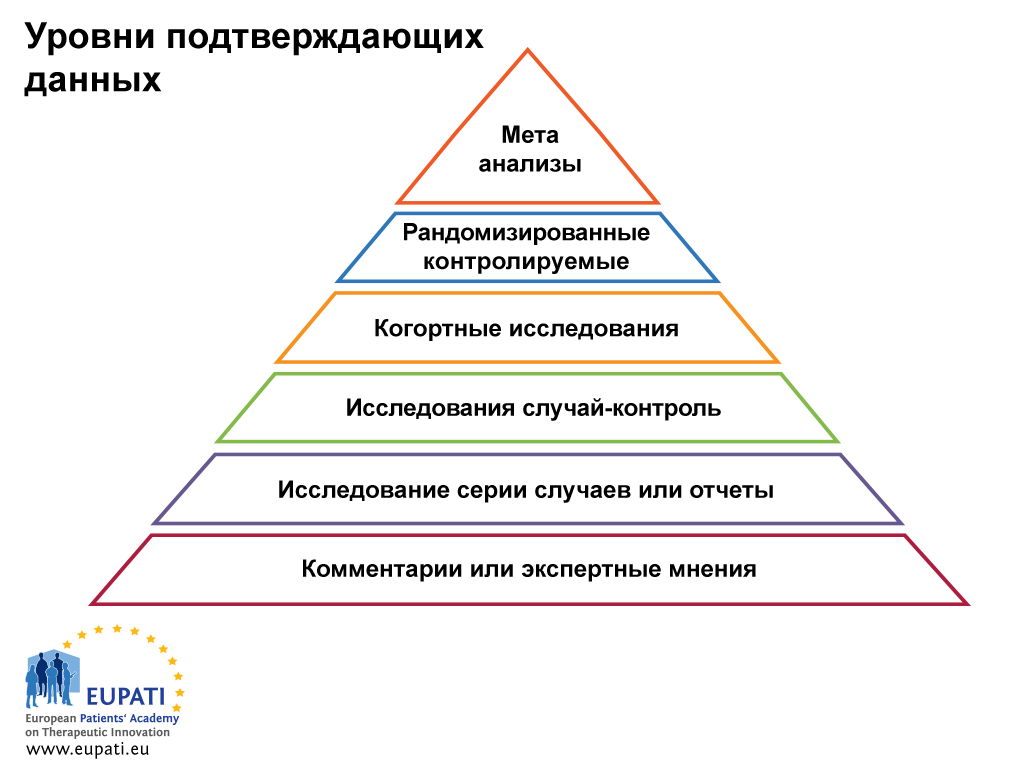
Доказательная медицина основывается на знаниях и лучших обобщенных подтверждающих данных об эффективности разных способов лечения и медицинской системы в целом. Важно при поиске подтверждающих данных о лечении не ограничиваться одной публикацией. При сравнении результатов из разных источников необходимо учитывать, что бывают разные уровни подтверждающих данных (см. рис. 1 ниже). Уровни подтверждающих данных представляют и классифицируют качество исследования и, следовательно, значимость подтверждающих данных, содержащихся в исследовании. Рандомизированные контролируемые слепые исследования представляют лучшие подтверждающие данные о преимуществах и рисках, но они не всегда доступны. Мета-анализ — основанная на статистических данных оценка, в которой сопоставляются и комбинируются результаты ряда исследований, связанных одной темой — это попытка выявить шаблоны, несоответствия и другие связи в нескольких исследованиях. Мета-анализ может служить подтверждением для более убедительного вывода по сравнению с любым отдельным исследованием, но необходимо помнить о недостатках, связанных с систематическими ошибками из-за предпочтительных публикаций положительных результатов исследования.
- Классификация подтверждающих данных по уровням удобна для оценки их качества.
Исследования подразделяются на следующие общие типы:
- Компетентное высококачественное рандомизированное испытание или мета-анализ рандомизированных испытаний со статистически выверенными результатами,
- рандомизированные испытания с низким уровнем компетентности, потенциально содержащие ошибки или противоречивые статистические результаты,
- нерандомизированные исследования с параллельным контролем,
- нерандомизированные исследования с историческим контролем (например, типичное несравнительное исследование 2 фазы),
- оценка экспертного комитета, описания клинических случаев, ретроспективные исследования.
Источники ошибок в публикациях
Три самых распространенных источника ошибок в публикациях1
- Риск неправильного использования и неверного толкования статистических тестови их результатов в связи с перепутанными значениями цифр (оценочных данных) и интерпретацией проверки гипотез (p-значений, мощности).
- Слепое прочесывание данных или проверка большого количества гипотез в одном наборе данных в поисках положительного эффекта. Когда множество гипотез проверяются с помощью одного набора данных, ряд гипотез практически наверняка неестественным образом оказываются статистически значимыми, хотя корреляций в действительности может не существовать. Если исследователи, которые используют методики интеллектуального анализа данных, действуют неосторожно, эти внешне значительные результаты могут ввести их в заблуждение.
- Погрешность. Погрешности в научных исследованиях возникают, когда при отборе данных или проверке гипотезы допускается системная ошибка в связи с предпочтительным выбором одного результата или ответа из всех остальных. Погрешность не всегда появляется в результате намеренных действий — она может быть внесена непреднамеренно.
Справочная литература
- Goldacre, B. (2010) Bad science: Quacks, hacks, and big pharma flacks. New York: Faber and Faber.
- Rennie, D., & Guyatt, G. (2002). Users' guides to the medical literature: A manual for evidence-based clinical practice. Chicago, IL: American Medical Association.
A2-4.35.1-v1.2