Last update: 11 Juli 2023
Allgemeine Grundsätze zur Patientenbeteiligung am gesamten Arzneimittelforschungs und -entwicklungsprozess
Die Europäische Patientenakademie (EUPATI) ist ein gesamteuropäisches Projekt der Innovative Medicines Initiative (IMI) von 33 Organisationen mit Partnern aus Patientenorganisationen, Universitäten, gemeinnützigen Organisationen und Pharmaunternehmen. EUPATI verwendet den Begriff ‚Patient‘ durchgehend für alle Altersgruppen und Krankheiten. EUPATI befasst sich nicht mit krankheitsspezifischen Themen oder Therapien, sondern mit dem Prozess der Arzneimittelentwicklung im Allgemeinen. Indikationsspezifische Informationen, altersspezifische oder einzelne Arzneimittel betreffende Therapien sind nicht Thema von EUPATI sondern fallen in die Zuständigkeit der Fachkräfte im Gesundheitswesen und von Patientenorganisationen. Um mehr zu erfahren besuchen Sie eupati.eu/.
Der Großteil der Experten, die an der Entwicklung und Bewertung von Arzneimitteln beteiligt sind, sind Wissenschaftler die sowohl im öffentlichen als auch im privaten Sektor arbeiten. Es ist zunehmend nötig auf das Wissen und die Erfahrungen von Patienten zurückzugreifen um zu verstehen wie es ist mit einer bestimmten Krankheit zu leben, wie die Betreuung abläuft, und Informationen über den täglichen Gebrauch von Arzneimitteln zu gewinnen. All dies hilft, die Entdeckung, Entwicklung und Bewertung neuer, wirksamer Arzneimittel zu verbessern.
Eine strukturierte Interaktion zwischen Patienten aller Altersgruppen und mit unterschiedlichen Krankheiten, deren Vertretern und anderen Akteuren (engl. Stakeholder) ist gefordert; sie ermöglicht den Informationsaustausch und einen konstruktiven Dialog auf nationaler und europäischer Ebene in allen Bereichen wo das Wissen und die Sicht der Nutzer von Arzneimitteln berücksichtigt werden können und sollten. Dabei ist wichtig zu bedenken, dass sowohl Gesundheitssysteme als auch Behandlungspraktiken und Gesetze unterschiedlich sein können.
Wir empfehlen eine enge Zusammenarbeit und Partnerschaft zwischen den verschiedenen Akteuren, wie Organisationen von Angehörigen der Gesundheitsberufe, Auftragsforschungsunternehmen, Patienten- und Verbraucherorganisationen*, Universitäten, wissenschaftlichen und akademischen Gesellschaften, Zulassungsbehörden, Gremien für Gesundheitstechnologiebewertung (engl. Health Technology Assessment bodies) und der Pharmaindustrie. Die bisherigen Erfahrungen haben gezeigt, dass die Beteiligung von Patienten die Transparenz, das Vertrauen und den gegenseitigen Respekt zwischen ihnen und anderen Akteuren erhöht hat. Es ist heute allgemein akzeptiert, dass die Mitwirkung von Patienten an der Entdeckung, Entwicklung und Bewertung von Arzneimitteln die Qualität der Ergebnisse und die Meinungsbildung bereichert hat.[1]
In bestehenden Verhaltensregeln (engl. Codes of practice) verschiedener Akteure zur Patientenbeteiligung wird der Bereich Forschung und Entwicklung (F&E) nicht umfassend abgedeckt. Die EUPATI-Leitlinien sollen helfen die Integration der Patientenbeteiligung in allen Bereichen der Arzneimittelforschung und -entwicklung zu fördern.
Sie sollen nicht als präskriptiv genommen werden, und es werden keine detaillierten Schritt-für-Schritt Anleitungen gegeben.
EUPATI hat die vorliegenden Leitlinien für alle Akteure entwickelt, die mit Patienten in der Arzneimittelforschung und -entwicklung (F&E) zusammenarbeiten wollen. Benutzer der Leitlinien können von diesen abweichen wenn besondere Umstände, nationale Gesetze oder spezifische Anforderungen einer Interaktion dies erfordern. Die Leitlinien sollten nach bestem professionellem Sachverstand individuellen Anforderungen angepasst werden.
Es gibt vier separate Leitlinien jeweils für eine Patientenbeteiligung in:
- Arzneimittelforschung- und entwicklung (F&E) der Pharmaindustrie
- Ethik-Kommissionen
- Zulassungsbehörden
- Gesundheitstechnologiebewertung (HTA).
Jede Leitlinie enthält Hinweise auf derzeit bestehende Möglichkeiten für eine Patientenbeteiligung. Die Leitlinien sollten regelmäßig überprüft und aktualisert werden.
Die vorliegende Leitlinie gilt für die Beteiligung von Patienten an der Ethikbewertung klinischer Studien.
Die Leitlinie baut auf den folgenden Grundsätzen auf, die durch Anwendung der vorgeschlagenen Arbeitspraktiken umgesetzt werden sollen (Abschnitt 8). Diese Grundsätze sind:
| Relevanz | Patienten verfügen über spezifisches Wissen, Erfahrungen und Perspektiven was zu Beratungen über ethische Themen ebeiträgt. |
| Fairness | Patienten haben dasselbe Recht wie andere Akteure bei der Ethikbewertung klinischer Studien mitzuwirken; sie haben Zugang zu Wissen und Erfahrungen, die ein effektives Engagement ermöglichen. |
| Gleichheit | Patientenbeteiligung an Ethikbewertungen trägt zur Gleichwertigkeit bei: ein besseres Verständnis der unterschiedlichen Bedürfnisse von Patienten mit speziellen Gesundheitsproblemen hilft, sie mit den Anforderungen der Industrie in Einklang zu bringen. |
| Vermittlung von Wissen und Handlungskompetenzen (Know-how) | Prozesse der Patientenbeteiligung adressieren Hindernisse, die einer Patientenbeteiligung an der Ethikbewertung entgegenstehen; sie erweitern die Handlungskompetenzen für eine Zusammenarbeit zwischen Patienten und Ethik-Kommissionen. |
Wie in den vier EUPATI Leitlinien ausgeführt, sollte sich jede zukünftige Leitlinie nach bestehenden nationalen Gesetzen zu Interaktionen richten.
Haftungsausschluss
EUPATI hat diese Leitlinie für alle Akteure entwickelt, die mit Patienten in allen Bereichen der Arzneimittelforschung und -entwicklung (F&E) zusammenarbeiten wollen.
Sie sollen nicht als präskriptiv genommen werden, und es werden keine detaillierten Schritt-für-Schritt Anleitungen gegeben. Der Gebrauch dieser Leitlinie sollte an besondere Umstände, nationale Gesetze oder spezifische Anforderungen einer Interaktion angepasst werden. Die Leitlinien sollten nach bestem professionellem Sachverstand individuellen Anforderungen angepasst werden.
Empfehlungen in dieser Leitlinie zu juristischen Aspekten sind nicht als rechtsverbindlich aufzufassen; sie sind kein Ersatz für eine formale Rechtsberatung. Falls eine formale Rechtsberatung erforderlich wird, sollten die jeweiligen Akteure ihre Rechtsabteilungen, falls vorhanden, zu Rate ziehen, oder Rechtsberatung von kompetenten Stellen einholen.
EUPATI übernimmt keine Haftung oder Gewähr für eine Nutzung dieser Leitlinie und jegliche Ergebnisse oder Schäden, die sich daraus ergeben
Das EUPATI Projekt erhielt Unterstützung vom Innovative Medicines Initiative Joint Undertaking [Gemeinsames Unternehmen zur Umsetzung der Technologieinitiative für innovative Arzneimittel] unter Förderungsvertrag Nr. 115334, dessen Haushaltsmittel zu gleichen Teilen aus dem 7. Rahmenprogramm [Seventh Framework Programme] der Europäischen Union (FP7/2007-2013) und von EFPIA Firmen stammen.
Einführung in die Patientenbeteiligung bei Ethikbewertungen
Um den optimalen Nutzen eines neuen Arzneimittels für Patienten und seinen kommerziellen Erfolg zu erzielen, fokussieren Pharmaunternehmen die Auswahl von Entwicklungskandidaten (Wirkstoffen) und die Definition relevanter Forschungsergebnisse auf die Bedürfnisse der an der jeweiligen Krankheit leidenden Patienten. Der „Fokus auf den Patienten” hat sich zu einem rasch wachsenden und zunehmend wichtigen Faktor in den Geschäftsmodellen von Pharmaunternehmen entwickelt. Er erfordert neue Strategien, neue Organisationsstrukturen und einen Kulturwandel im gesamten Pharmabereich. Er braucht die Partnerschaft mit Patientenexperten, die imstande sind, Empfehlungen zum Nutzen von Behandlungen und patientenrelevanten Ergebnissen zu geben. Dieser Fokus auf den Patienten ist aber auch für andere am Arzneimittel-Entwicklungsprozess beteiligte Akteure wichtig, vor allem die Ethik-Kommissionen, die sich für den Patientenschutz in klinischen Studien einsetzen.
Ein gutes klinisches Prüfungsdesign ist sowohl ethisch als auch wissenschaftlich fundiert. Bei den Entscheidungen über das Design müssen unter anderem die folgenden Fragen beantwortet werden: soll das neue Arzneimittel mit einem anderen Arzneimittel oder einem Plazebo verglichen werden, wie sollen die Studienteilnehmer ausgewählt werden, und welche Tests und Analysen sollen durchgeführt werden (und wie oft). Das Risiko möglicherweise schädlicher Nebenwirkungen muss gegenüber dem potentiellen Nutzen für die teilnehmenden Patienten abgewogen werden, wie z. B. früher Zugang zu neuen Arzneimitteln, intensivere Diagnostik und Überwachung, und die Möglichkeit zur Entwicklung neuer Therapien für andere Patienten, die an derselben Krankheit leiden, beizutragen. Patienten und Wissenschaftler können über diese Risiken und Vorteile unterschiedlicher Meinung sein: z. B. mögen Patienten, je nach der Schwere der betreffenden Krankheit, bereit sein, ein größeres Risiko in Bezug auf potentielle Nebenwirkungen einzugehen Derzeit ist Patientenbeteiligung an diesen Entscheidungen nicht die Norm; dies gilt gleichermaßen für klinische Prüfungen, die von Pharma- oder Biotechnologiefirmen oder von akademischen Institutionen initiiert werden.
Klinische Studien unterliegen sehr strikten gesetzlichen Vorschriften. Vor dem Start einer klinischen Studie muss die Studie von der zuständigen Zulassungsbehörde genehmigt werden; sie stellt sicher, dass alle gesetzlichen Auflagen erfüllt sind, die Studie wissenschaftlich fundiert ist, die Studienmedikation von nachgewiesener Qualität und sicher ist (basierend auf vorklinischen und – falls verfügbar –klinischen Daten), und der erwartete Nutzen größer ist als die Risiken. Parallel zur Prüfung durch die zuständige Zulassungsbehörde bewerten eine oder mehrere multidisziplinäre (Forschungs-) Ethik-Kommissionen das Studienprotokoll und die zugehörigen Dokumente, um den Schutz der Studienteilnehmer zu gewährleisten. Sie stellen sicher, dass die Patienteninformationen umfassend und verständlich sind. Sie beurteilen das Nutzen/Risiko Verhältnis und gewährleisten dass es akzeptabel ist und die Studie für Patienten mit der jeweiligen Krankheit wissenschaftlich relevant ist.
In den meisten europäischen Ländern sind Patienten, Betreuer oder Patientenvertreter nur am Rande oder überhaupt nicht an der ethischen und wissenschaftlichen Bewertung klinischer Studien beteiligt. In den nationalen Gesetzen der meisten europäischen Länder sowie in der neuen EU Verordnung über klinische Prüfungen [EU Clinical Trials Regulation] (Verordnung (EU) 536/2014) ist die Patientenbeteiligung an der Definition der ethischen Voraussetzungen für klinische Prüfungen und der Bewertung durch die Ethikkommissionen nicht klar definiert. Die Verordnung legt folgendes fest: „Bei der Auswahl der geeigneten Stelle(n) (z. B. Ethik-Kommissionen), die an der Bewertung von Anträgen beteiligt ist/sind, sollten die Mitgliedsstaaten darauf achten, dass auch Laien einbezogen werden, insbesondere Patienten oder Patientenorganisationen.”[2]
Während Patientenbeteiligung an F&E in der Pharma- und Biotechnologieindustrie zunehmend akzeptiert wird, ist sie bei Ethik-Kommissionen oft umstritten. Ethik-Kommissionen sind Experten-Beratergruppen, die Empfehlungen zur ethischen Akzeptabilität von am Menschen durchgeführten Forschungsprojekten abgeben. Sie sind gegenüber der Öffentlichkeit dem Schutz der Studienteilnehmer verpflichtet. Um diese Verpflichtung erfüllen zu können, müssen die Kommissionsmitglieder unabhängig, neutral und objektiv sein und über wissenschaftliche, ethische und methodologische Qualifikationen verfügen. Die Beteiligung von Laien sollte die Neutralität unterstützen und den Rahmen der Empfehlungen um neue Perspektiven erweitern. Die Hinzunahme von Patienten als Mitglieder in Ethik-Kommissionen stellt einen Paradigmenwechsel dar: Patienten sitzen mit am Tisch; sie repräsentieren diejenigen, denen die Forschung letztlich zugutekommt; es mag allerdings sein, dass sie – als Beteiligte – die Vorteile einer Teilnahme an der Studie überschätzen oder die Risiken unterschätzen. Aber die Überlegungen, auf denen das Konzept des „Fokus auf den Patienten” in F&E beruht, treffen auch hier wohl zu: das Ergebnis kann verbessert werden, wenn die betroffene Partei ihren sachkundigen Beitrag leistet. Es besteht Bedarf für eine allgemein akzeptierte Leitlinie, die die Bedingungen und Vorgehensweisen einer Zusammenarbeit zwischen Ethik-Kommissionen und Patienten bei der Ethikbewertung definiert.
Geltungsbereich
Die vorliegende Leitlinie wurde von der europäischen Patientenakademie zu Therapeutischen Innovationen (EUPATI) für alle an der Arzneimittelentwicklung beteiligten Akteure entwickelt, die an der Ethikbewertung klinischer Forschungsprojekte teilnehmen; sie richtet sich insbesondere an die Mitglieder der Ethik-Kommissionen und die beteiligten Patienten/Betreuer oder Patientenvertreter.
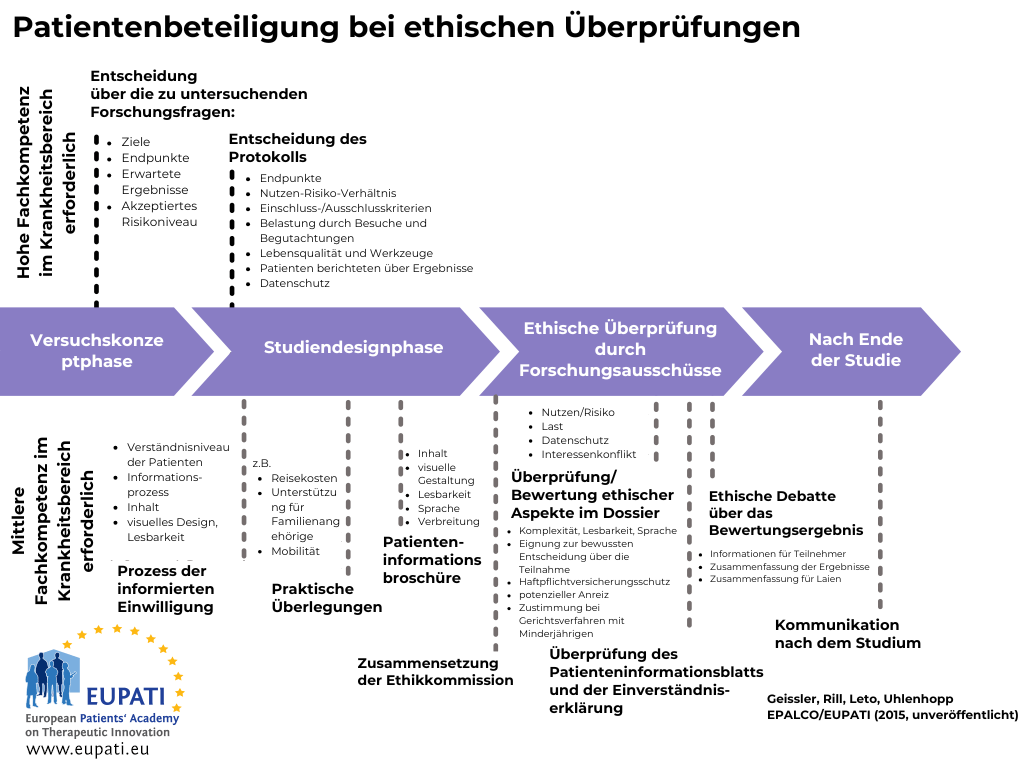
Die vorliegende Leitlinie gilt für die Beteiligung von Patienten an der Ethikbewertung klinischer Studien. Ethische Aspekte müssen bei einer klinischen Prüfung laufend beachtet werden – von der Definition der Forschungsinhalte und Protokollbedingungen bis zur Abfassung der Einwilligungserklärung, der Ethikbewertung durch die Ethik-Kommissionen und der Veröffentlichung der Studienergebnisse. Siehe Abbildungen 1 und 2. Diese Leitlinie beinhaltet die Patientenbeteiligung bei all diesen Schritten, der Fokus liegt jedoch besonders auf der Patientenbeteiligung an Ethik-Kommissionen.
Die Leitlinie basiert auf Diskussionen und Ergebnissen eines Rundtischgespräches mehrerer Akteure und eines Webinars über Patientenbeteiligung, beides organisiert von EUPATI, Beiträgen nationaler Ethik-Kommissionen, Beratungen innerhalb des EUPATI Konsortiums und einem umfassenden externen Konsultationsprozess.
Definition des Begriffs „Patient”
Der Begriff „Patient” wird oft allgemein und ungenau verwendet und reflektiert nicht die variierenden Anforderungen an Beiträge und Erfahrungen von Patienten, Patientenvertretern und Patientenorganisationen in unterschiedlichen Kooperationsprozessen.
Zum besseren Verständnis der Terminologie der in dieser und anderen EUPATI Leitlinien beschriebenen möglichen Rollen der Interaktion mit Patienten - definieren wir den Begriff „Patient” wie folgt:
- „Individuelle Patienten” sind Personen, die persönliche Erfahrung mit einer Krankheit haben. Sie haben, oder haben nur wenig, technisches Wissen über F&E oder regulatorische Prozesse; ihre Hauptaufgabe ist es über ihre persönliche Erfahrung mit der Krankheit und deren Behandlung zu informieren.
- „Betreuer” sind Personen, die individuellen Patienten Beistand leisten, z. B. Familienmitglieder oder bezahlte oder ehrenamtliche Helfer.
- „Patientenvertreter” sind Personen, die Einblicke und Erfahrung in der Zusammenarbeit mit größeren Patientengruppen haben die mit einer bestimmten Krankheit leben. Sie können, müssen aber nicht, mit einer Organisation verbunden sein.
- „Vertreter einer Patientenorganisation” sind Personen, die das Mandat haben den kollektiven Standpunkt einer Patientenorganisation zu einem bestimmten Thema oder einem Krankheitsgebiet zu vertreten und darzustellen.
- „Patientenexperten” haben, abgesehen von einer krankheitsspezifischen Expertise, auch das technische Wissen in F&E und/oder regulatorischen Angelegenheiten durch Ausbildung oder Erfahrung, z. B. EUPATI Fellows; denen von EUPATI das gesamte Spektrum der Arzneimittelforschung und -entwicklung (F&E) in einem extensiven Kurs vermittelt wurde.
Einige Akteure haben vielleicht Bedenken bezüglich der Einbeziehung einzelner Patienten in eine Kollaboration, weil sie annehmen, deren Beiträge seien subjektiv und könnten kritisiert werden. EUPATI demgegenüber, in Einklang mit den Zulassungsbehörden, vertritt das Prinzip der Gleichwertigkeit, indem eine Beteiligung von Einzelpersonen nicht ausgeschlossen wird. Es sollte der Organisation(en), die eine Interaktion initiiert überlassen bleiben die zweckmäßigste Art der Patientenvertretung durch Auswahl des adäquaten Patiententyps für die jeweilige Aktivität zu bestimmen (siehe Abschnitt 7). Es wird empfohlen, dass im Fall der Teilnahme einzelner Patienten die entsprechende Patientenorganisation, falls vorhanden, informiert und/oder konsultiert wird um Unterstützung oder Rat geben zu können.
Vor jeder Beteiligung an einer Kooperation sollte die Art des Beitrags und das Mandat mit der teilnehmenden Person abgestimmt werden.
Aktuelle Situation der Patientenbeteiligung an Ethikbewertungen
Best-Practice Beispiele haben gezeigt, dass Patientenbeteiligung an ethischen Erwägungen zu klinischen Studien bereits in der Vorbereitung des Studiendesigns und des Studienprotokolls das Bewusstsein über ethische Aspekte bei Forschungsprojekten positiv beeinflusst. Eine Beteiligung in diesem Stadium kann garantieren, dass der Fokus auf den Patienten maximiert wird, und die Studienziele relevant für die Patienten sind. Die EUPATI „Leitlinie für Patientenbeteiligung an Arzneimittelforschung und -entwicklung der Pharmaindustrie“ enthält Informationen zu diesem Thema [3]. In ähnlicher Weise könnten Patientenexperten für klinische Studien von wissenschaftlichen Sponsoren sinnvolle Beiträge leisten.
Zum Zeitpunkt der Ethikbewertung einer klinischen Studie durch die Ethik-Kommission sind die Einzelheiten des Studienprotokolls bereits festgelegt. Die Prüfung durch die Mitglieder der Ethik-Kommission konzentriert sich auf Akzeptabilität des spezifischen Nutzen-Risiko Verhältnisses, Patientenschutz, Eignung des Prüfzentrums sowie die Informationen, die Patienten während des Einwilligungsprozesses erhalten. Eine Ergänzung durch die Patientenexpertise kann eine relevante Erweiterung der Expertise eines Komitees bedeuten.
Seit längerem ist die Beteiligung mindestens eines Laien an Ethik-Kommissionen üblich und ihr Wert ist unbestritten. Art und Umfang der Patientenbeteiligung allerdings variiert beträchtlich zwischen- und sogar innerhalb – der europäischen Mitgliedsstaaten. In einigen Ländern ist die Patientenvertretung gesetzlich gefordert und die Bedingungen sind klar definiert. In anderen Ländern beginnen einzelne Ethik-Kommissionen gerade damit, die Patientenbeteiligung zu implementieren, entweder im Rahmen der Flexibilität ihrer Statuten bezüglich der Zusammensetzung der Kommission, oder weil die Gesetze es ihnen freistellen, ob sie Laien oder Patientenvertreter einbeziehen. Diese unterschiedlichen Praktiken existieren aus den folgenden Gründen:
- Obwohl die Vorteile einer Patientenbeteiligung gesehen werden, herrscht keine Übereinstimmung über die Rolle und das am besten geeignete Profil eines Patienten: Patientenexperte, Patientenvertreter, Vertreter einer Patientenorganisation oder individueller Patient.
- Es ist schwierig für Ethik-Kommissionen Patienten zu finden, die bereit sind an einer Ethikbewertung teilzunehmen; dies gilt europaweit. Es gibt keinen „Matchmaking” Prozess.
- Es kann ein logistisch schwierig sein Patienten mit bestimmten Krankheiten zu gewinnen; andererseits müssen Patienten, die an Diskussionen über verschiedene Krankheiten teilnehmen sollen, Sachkenntnisse haben die über ihre Krankheit hinausgehen.
- Die Meinungen sind geteilt, inwieweit Patienten mit einer bestimmten Krankheit andere Patienten mit derselben Krankheit vertreten können oder wollen, und ob sie aufgrund ihrer persönlichen Interessen möglicherweise voreingenommen sind. Die Unabhängigkeit der Vertreter von Patientenorganisationen wurde in Frage gestellt, weil ihre persönlichen Interessen und die finanzielle Unterstützung von Seiten der Pharmaindustrie zu Interessenkonflikten führen könnten.
- In Europa gibt es derzeit nur eine begrenzte Anzahl geeigneter Patientenexperten.
Bisher haben nur wenige Patientenorganisationen beschlossen einzelne Mitglieder für eine aktive Rolle in der Ethikbewertung und besonders in Ethik-Kommissionen zu identifizieren und auszubilden.
Ab 2018 wird die Genehmigung und Durchführung klinischer Prüfungen durch die EU Verordnung über klinische Prüfungen [EU Clinical Trials Regulation] (Verordnung (EU) 536/2014) geregelt. Patientenbeteiligung am Ethikbewertungsprozess ist in dieser Verordnung nicht festgelegt, obwohl das Gesetz vorschreibt, dass Laien, insbesondere Patienten oder Patientenorganisationen, an der Beurteilung klinischer Studienanträge beteiligt sein sollen. Der Bewertungsprozess und die Zusammensetzung der Bewertungsgremien (nationale Zulassungsbehörden und Ethik-Kommissionen) werden durch die nationalen Gesetze bestimmt, und daher wird sich die Patientenbeteiligung am Ethikbewertungsprozess weiterhin von Land zu Land unterscheiden.
Zeitpunkt und Art der Patientenbeteiligung an Ethikbewertungen
Patienten können in die Ethikbewertung klinischer Studien zu verschiedenen Zeitpunkten einbezogen werden (Abschnitt 4):
- Studienkonzept-Phase (wird vom kommerziellen oder akademischen Sponsor durchgeführt)
- Studiendesign-Phase (wird vom kommerziellen oder akademischen Sponsor durchgeführt)
- Ethikbewertungs-Phase (wird von der/n Ethik-Kommission/en durchgeführt)
- Phase nach dem Studienende (wird vom kommerziellen oder akademischen Sponsor durchgeführt)
In der Studienkonzept-Phase können Patientenexperten zu ethischen Aspekten der Studie Stellung nehmen, wie z.B.:
- Beurteilung der präklinischen Daten und/oder Hintergrundinformationen
- Forschungsfragen, z. B. für spezifische Indikationen, Patientenpopulationen, etc.
- Definition der Studienziele, um die Relevanz für Patienten sicherzustellen
- Einschluss- und Ausschlusskriterien von Studienteilnehmern
- akzeptable/relevante Endpunkte
- die Angemessenheit von Messungen und Untersuchungen, z. B. Fragebögen über Lebensqualität und Patientenberichte über Ergebnisse (Patient Reported Outcomes)
- Vergleichsprodukte (Plazebo oder aktives Vergleichsprodukt) und deren Akzeptabilität für die Teilnehmer
- Annehmbare Risiken: Patienten können eine bestimmte Meinung zu dem Risiko haben, das sie bereit sind zu akzeptieren
Wir empfehlen, dass Patientenexperten in die Studienkonzept-Phase einbezogen werden unabhängig davon ob die Studie von einem Unternehmen oder einer akademischen Institution durchgeführt wird; ihre Teilnahme erhöht den wissenschaftlichen Wert und die Machbarkeit einer Studie.
In der Studiendesign-Phase können Patientenexperten Stellung zu Studiendetails nehmen, die so definiert sein müssen dass:
- eine geeignete Anzahl von Teilnehmers innerhalb eines bestimmten Zeitraums eingeschlossen werden kann,
- bei einer Studienteilnahme der Nutzen die Risiken überwiegt,
- die Belastung der Studienteilnehmer annehmbar ist,
- die Betreuung der Teilnehmer zufriedenstellend ist,
- idie Verabreichung des Prüfprodukts so einfach und zuverlässig wie möglich ist,
- die Messungen und Untersuchungen praktikabel, für die Teilnehmer akzeptierbar und zuverlässig sind.
- die Patienten über die Studienergebnisse informiert werden, selbst wenn die Studie frühzeitig abgebrochen wird
- die Patientengruppe, für die die Studie durchgeführt wird, einen Nutzen aus den Ergebnissen ziehen kann
Obwohl Patienten wertvolle Beiträge zu vielen anderen Aspekten leisten können, ist ihre Beteiligung in dieser Phase typischerweise die Erarbeitung des Patienteninformations-Prozesses, einschließlich der Vorbereitung der Patienteninformation und des Einwilligungsformulars. Die Mitwirkung von Patienten der Zielgruppe an diesen Dokumenten kann deren Verständlichkeit, Anwenderfreundlichkeit und Vollständigkeit verbessern.
Wir empfehlen, dass Patientenexperten in die Studiendesign-Phase einbezogen werden unabhängig davon ob eine Studie von einem Unternehmen oder einer akademischen Institution durchgeführt wird; ihre Teilnahme soll dazu beitragen die Studienbedingungen für die Teilnehmer akzeptabel zu machen und die Relevanz der Studienergebnisse für die jeweilige Patientengruppe (patient community) zu erhöhen.
In der Ethikbewertungs-Phase, die von einer oder mehreren Ethik-Kommissionen durchgeführt wird, können Patientenexperten oder Patientenvertreter wichtige Beiträge zu den oben beschriebenen Themen leisten. Darüber hinaus können Patienten zu den Studienbedingungen vor Ort Empfehlungen geben, wie:
- Bewertung des Nutzen/Risiko Verhältnisses
- Fairness der Einschluss- und Ausschlusskriterien
- Angemessenheit der Patienten-Haftpflichtversicherung
- Datenschutzmaßnahmen
- Potentielle Interessenkonflikte
- Verständlichkeit und Akzeptabilität der Einwilligungsdokumente
- Vermeidung von Anreizen, z. B. Sicherstellung, dass Patientenhonorare und Reisekosten angemessen sind
- Beiträge von Patientenorganisationen zur Patientenaufklärung und zum Rekrutierungsprozess
Wir empfehlen, dass Patientenexperten, Vertreter von Patientenorganisationen oder Patientenvertreter, die sachkundig bezüglich der betreffenden Krankheit sind, in die von Ethik-Kommissionen durchgeführten Bewertungen klinischer Studien einbezogen werden, um einen optimalen Schutz der Studienteilnehmer zu erreichen.
Bisher werden nur in Ausnahmefällen Patienten von den Sponsoren in die Kommunikation mit Studienteilnehmern nach dem Studienende involviert. Unter der neuen EU Verordnung über klinische Prüfungen müssen aber die Ergebnisse jeder klinischen Studie für Laien zusammengefasst werden um Transparenz zu sichern und die Beiträge der Patienten Community zu der Studie zu würdigen. Eine Beteiligung von Patienten an der Ergebniszusammenfassung für Laien ist essentiell, um sicherzustellen dass sie für Patienten geeignet und verständlich abgefasst ist.
Wir empfehlen, dass kommerzielle/akademische Sponsoren Patientenexperten oder Vertreter von Patientenorganisationen, die sachkundig bezüglich der betreffenden Krankheit sind, bei der Abfassung von Zusammenfassungen für Laien einbeziehen, um sicherzustellen, dass die Informationen unparteiisch, für Patienten geeignet und verständlich sind.
Praktische Aspekte der Patientenbeteiligung an Ethik-Kommissionen
Nationale Gesetze legen die Zusammensetzung, Organisation und den Verantwortungsbereich der Ethik-Kommissionen fest; sie reflektieren die Aufgaben der verschiedenen Ethik-Kommissionen beim Schutz der Studienteilnehmer und der Sicherstellung der Integrität der Forschung.
Für Patienten können in Ethik-Kommissionen verschiedene Rollen in Betracht kommen:
- als Vollmitglied einer Ethik-Kommission mit gleichen Rechten und Pflichten wie die anderen Mitglieder
- als externer Gutachter (Peer Reviewer), der vor einer Sitzung Empfehlungen an Mitglieder der Ethik-Kommission gibt
Der Auswahlprozess von Mitgliedern für Ethik-Kommissionen ist in verschiedenen Ländern unterschiedlich und durch nationale Gesetze, zuständige professionelle Gremien oder die Standardarbeitsanweisung (Standard Operating Procedure (SOP)) der jeweiligen Ethik-Kommission geregelt.
Patientenexpertise
Ethik-Kommissionen sollten begründete Entscheidungen bezüglich der Expertise, die sie von ihren Patientenmitgliedern erwarten, treffen:
- „Individuelle Patienten,” mit der betreffenden Krankheit, Eltern oder Betreuer dieser Patienten, können wertvolle Beiträge zur Information für Patienten und dem Einwilligungsformular leisten; sie können mit einem Blick von außen zu Themen, wie z. B. Lebensqualität und Belastung der Teilnehmer durch die Studie Stellung nehmen. Es ist jedoch möglich, dass Patienten nach ein paar Monaten Erfahrung nicht mehr „Forschungs-naiv“ sind, und es wird argumentiert dass dies den Wert ihrer Beiträge beeinflussen könnte. Es kann für „Forschungs-naive“ Patienten schwierig sein an Diskussionen zu ethischen Themen teilzunehmen die wissenschaftlich und/oder methodologisch komplex sind. Die Beiträge von „Forschungs-naiven“ Patienten ohne Erfahrung mit der betreffenden Krankheit könnten als vergleichbar zu denen von Laien angesehen werden.
- „Patientenvertreter” haben aus eigener Erfahrung detaillierte Kenntnisse über das Leben mit der Krankheit und möglicherweise ein gewisses Verständnis für die Forschung und Arzneimittelentwicklung zu dieser Krankheit. Mit jeder Teilnahme an einer Ethikbewertung gewinnen sie mehr Erfahrung. Ihre Empfehlungen mögen jedoch nur eingeschränkt repräsentativ sein, als dass sie wenig tiefergehende Erfahrung mit Fällen über ihren eigenen hinaus oder ein paar weiteren haben. Ihr Beitrag zur Ethikbewertung klinischer Studien zu anderen Krankheiten wird auf eine allgemeine Patientenperspektive beschränkt sein.
- „Vertreter von Patientenorganisationen” sind entweder Patienten mit der betreffenden Krankheit, und/oder sind aktiv in einer entsprechenden Patientenorganisation und haben daher Zugang zu den Krankheitserfahrungen vieler Patienten. Sie kennen die Bedürfnisse, Wünsche und Meinungen dieser Community, und ihre Aussagen sind daher relativ repräsentativ. Da Patientenorganisationen ihre Mitglieder unterstützen und Lobbyarbeit für ihre Interessen betreiben ist es wichtig, dass ihre Vertreter in Ethik-Kommissionen der Verpflichtung gewahr sind, ihre Empfehlungen unvoreingenommen zu geben. Ihr Beitrag zur Ethikbewertung klinischer Studien zu anderen Krankheiten beschränkt sich auf allgemeine Perspektiven der Patientenorganisation.
- „Patientenexperten” (z. B. EUPATI Fellows) haben persönliche Erfahrung mit der Krankheit und/oder das kumulierte Wissen aus der Zusammenarbeit mit Mitgliedern ihrer Patientenorganisation. Darüber hinaus besitzen sie ein umfassendes Wissen über alle Aspekte des Arzneimittel-Entwicklungsprozesses und können aktiv, und auf gleicher Ebene mit anderen Kommissionsmitgliedern, zu allen Themen der Ethikdiskussionen beitragen. In der Ethik-Kommission sind sie nicht als Repräsentant, sie haben aber durch ihre Aktivitäten in ihrer Patientenorganisation Kontakt zu vielen anderen Fällen. Ihr Beitrag zur Ethikbewertung von Studien für andere Krankheiten kann auch wegen ihres Wissens über F&E wertvoll sein.
Wir empfehlen, dass Patientenexperten, Vertreter von Patientenorganisationen oder Patientenvertreter, die sachkindig über das Leben mit der in Frage stehenden Krankheit sind, an der Arbeit der Ethik-Kommissionen, bevorzugt als Vollmitglieder, mitwirken um ihren Beitrag über die Entwicklung der Informationsbroschüren und Einwilligungsformulare hinaus zu erweitern.
Identifizierung von interessierten Patienten und interessierten Ethik-Kommissionen
Ethik-Kommissionen berichten, dass es schwierig ist Patienten für die Teilnahme zu gewinnen, und insbesondere Patienten mit der verlangten Expertise. Es ist einfacher „generische” Patientenvertreter zu finden, die Studien zu verschiedenen Krankheiten bewerten, allerdings mit den bereits beschriebenen Nachteilen. Die Identifizierung von Patientenmitgliedern für bestimmte Krankheiten und die Organisation ihrer Teilnahme an den Sitzungen der Ethik-Kommission, kann logistisch schwierig sein. Patienten können jedoch an Sitzungen der Ethik-Kommissionen auch via Telefon- und Web-Zuschaltung teilnehmen. Patienten können auch gebeten werden schriftliche Stellungnahmen vor den Sitzungen der Ethik-Kommissionen abzugeben; das bedeutet aber, dass ihr Einfluss auf die Ethikdiskussion während der Sitzungen verloren geht.
Es gibt verschiedene Möglichkeiten für Ethik-Kommissionen interessierte Patienten zu identifizieren und für interessierte Patienten mit Ethik-Kommissionen zusammenzukommen:
- Ethik-Kommissionen können in Zusammenarbeit mit Patientenorganisationen und/oder deren Dachverbänden Schulungsmöglichkeiten für die Ethikbewertung etablieren.
- Werbung
- Nutzung bestehender Kontakte
- Initiativbewerbungen (Blindbewerbungen) von Patienten
- Unterstützung der Entwicklung einer nationalen "Matchmaking" Plattform mit akademischen und kommerziellen Sponsoren zur Erleichterung einer Zusammenarbeit mit interessierten Patienten mit unterschiedlichen Krankheiten und unterschiedlicher Expertise.
Wir empfehlen dass einzelne Ethik-Kommissionen eine Datenbank von Patienten entwickeln, die bereit sind an Ethikbewertungen teilzunehmen, und wir ermutigen Ethik-Kommissionen sich zusammenzuschließen und eine übergreifende, z.B. nationale oder regionale, Datenbank einzurichten.
Wir empfehlen Patientenorganisationen eine Datenbank von Mitgliedern zu erstellen, die an der Ethikbewertung klinischer Studien interessiert und entsprechend geschult sind. Patientenorganisationen sollten die nationalen Ethik-Kommissionen über eine solche Datenbank informieren.
Voraussetzungen für eine Patientenbeteiligung an Ethik-Kommissionen
Um eine reibungslose und effiziente Zusammenarbeit zu garantieren, sollten interessierte Patienten oder Patientenvertreter über die Voraussetzungen einer Teilnahme an der Arbeit von Ethik-Kommissionen informiert werden.
Schriftliche Vereinbarung
Die Parteien sollten eine schriftliche Vereinbarung unterzeichnen, die Rolle des Patienten im Ethikbewertungsprozess klar beschreibt. Die Vereinbarung sollte die gesetzlichen und regulatorischen Voraussetzungen, die Arbeitsvorgänge, die Grundregeln und Maßnahmen zur Konfliktbereinigung, die Häufigkeit der Interaktionen, die gegenseitigen Verpflichtungen einschließlich Vertraulichkeit, Haftpflicht- und Versicherungsschutz, Ressourcenanforderungen, Zeitpläne und Vergütungs-/Erstattungsmechanismen und andere Vergünstigungen festlegen.
Wir empfehlen, dass die Parteien die schriftliche Vereinbarung vor Beginn der Zusammenarbeit unterzeichnen, so dass Klarheit über die Zusammenarbeit vorab garantiert ist.
Transparenz
Es gilt für Patientenmitglieder ebenso wie für alle anderen Mitglieder einer Ethik-Kommission, dass ihre eigenen (und/oder auch die der Patientenorganisation) professionellen Interessen und finanzielle Unterstützung nachvollziehbar sein müssen.
Wir empfehlen, dass Patientenmitglieder dieselbe Interessenerklärung wie die anderen Mitglieder der Ethik-Kommission unterschreiben und potentielle Interessenkonflikte auflisten, wie z. B. professionelle Beteiligungen und finanzielle Interessen an anderen Organisationen sowie persönliche und professionelle Einkommensquellen (falls der Patient Vertreter einer Patientenorganisation ist).
Repräsentativität
Der repräsentative Charakter der Empfehlungen von Patientenmitgliedern ist sowohl für die Ethik-Kommission als auch für die Patienten Community bedeutsam. Nur wenige Patientenorganisationen speichern systematisch Informationen, die bei der Ethikbewertung einer klinischen Studie in ihrem Indikationsbereich relevant sind, und nominieren geeignete Mitglieder, die ihre Organisationen in einer Ethik-Kommission repräsentieren könnten.
Wir empfehlen, dass Patientenorganisationen Mitglieder identifizieren, die ihre Organisationen in einer Ethik-Kommission repräsentieren möchten; Patientenorganisationen sollten sicherstellen, dass diese umfassend über den Behandlungsbedarf, Defizite in der Lebensqualität und Lebensumstände der betroffenen Patienten Community informiert sind.
Wir empfehlen, dass Patientenorganisationen einen Prozess für den Austausch von Erfahrungen, die ihre Patientenmitglieder in Ethik-Kommissionen sammeln, entwickeln; die Vertraulichkeitsverpflichtungen der Patientenmitglieder müssen dabei respektiert werden.
Nominierung, Einführung und Training
Der Nominierungsprozess und die Einführung von Patientenmitgliedern sollten den Standardregeln der jeweiligen Ethik-Kommission folgen.
Die Teilnahme an einer Ethikbewertung in einer Ethik-Kommission ist für viele Patienten oder Vertreter eine Patientenorganisation eine neue Erfahrung. Diskussionen mit Experten können einschüchternd wirken und dazu führen, dass Patienten weniger aktiv teilnehmen: Es ist wichtig, dass die bloße Anwesenheit von Patientenvertretern nicht als gegebene Zustimmung zu Entscheidungen der Kommission betrachtet wird. Um eine echte Beteiligung zu fördern, muss die Kompetenz von Patienten, die Erfahrung mit Empfehlungen an Ethik-Kommissionen haben, systematisch vergrößert werden. Dies sollte eine umfassende Einführung in die Aktivitäten eines Mitglieds der Ethik-Kommission und Initiativen zur kontinuierlichen professionellen Weiterbildung enthalten, selbst wenn sich die Beiträge des Patienten nur auf das eigene Krankheitsgebiet beschränken.
Wir empfehlen, dass Patientenmitglieder eine umfassende Einführung und fortlaufendes Training erhalten, unabhängig davon wie oft sie an einer Ethikbewertung teilnehmen.
Vergütung
Es sollte bedacht werden, dass, wenn Patienten sich an Aktivitäten beteiligen, dies oft ehrenamtlich, entweder als Einzelperson oder auch als Mitglied einer Organisation, geschieht. Es ist daher auch Folgendes zu berücksichtigen:
- Die Teilnehmer sollten für ihre gesamte aufgewendete Zeit und Auslagen entschädigt werden
- Jede Aufwandsentschädigung sollte fair sein und sich nach der Art der Tätigkeit richten. Im Idealfall sollten Reisekosten direkt von der Organisation, die die Beteiligung fördert, gezahlt anstatt rückerstattet werden.
- Es sollte ebenfalls erwogen werden Patienten organisationen, die Patienten für die Teilnahme an Aktivitäten identifizieren und sponsern (z. B. Unterstützung durch Peer-Gruppen, Training und Vorbereitung) für diese Ausgaben zu entschädigen.
- Logistische Unterstützung für eine Patiententeilnahme, einschließlich Reisen und/oder Unterbringung, sollte angeboten werden.
Unter Aufwandsentschädigung fallen auch indirekte Sachleistungen (z. B. eine Patientenorganisation bietet Dienstleistungen kostenlos an) oder andere nicht-finanzielle Leistungen für Patienten/Patientenorganisationen (z. B. Trainingsveranstaltungen, Einrichtung von Webseiten).
Die Vergütungsvereinbarungen aller Parteien sollten nachvollziehbar sein.
Quellenangaben
- Adapted from the EMA framework. European Medicines Agency (2022). EMA/649909/2021 Adopted. https://www.ema.europa.eu/en/documents/other/engagement-framework-european-medicines-agency-and-patients-consumers-and-their-organisations_en.pdf. Last Accessed 12 February 2024.
- EU Regulation on clinical trials on medicinal products for human use No. 536/2014. (2014) https://ec.europa.eu/health/human-use/clinical-trials/regulation_en. Last Accessed 6 July, 2021
- Leitlinie für die Beteiligung von Patienten an von der Industrie geleiteten Arzneimittelfoschung und -entwicklung (2016). https://toolbox.eupati.eu/resources/leitlinie-fuer-die-beteiligung-von-patienten-an-von-der-industrie-geleiteten-arzneimittelfoschung-und-entwicklung/?lang=de Last accessed 27 July, 2021
*Verbraucher sind als Akteure im Gesundheitsdialog anerkannt. EUPATI fokussiert auf Patienten und nicht auf Verbraucher; dies spiegelt sich in den Schulungsmaterialien und Leitlinien.
Anlagen