Last update: 17 Δεκεμβρίου 2022
Εισαγωγή
Η εξατομικευμένη ιατρική (EI) είναι ένα ιατρικό μοντέλο που προτείνει την προσαρμογή των ιατρικών αποφάσεων, πρακτικών και θεραπειών στις ιδιαιτερότητες του κάθε ασθενούς. Εφαρμόζει στοχευμένα φάρμακα που στοχεύουν σε συγκεκριμένα μόρια που εμπλέκονται στην ασθένεια του ασθενούς και λαμβάνει υπόψη γενετικές, κλινικές, περιβαλλοντικές πληροφορίες και πληροφορίες σχετικά με τον τρόπο ζωής του ασθενούς. Στόχος είναι η επιλογή των κατάλληλων θεραπειών για τον εκάστοτε ασθενή, ώστε να εξασφαλιστεί το καλύτερο δυνατό αποτέλεσμα και να μειωθεί ο κίνδυνος παρενεργειών.
Η πρόοδος στην κατανόηση της σχέσης μεταξύ της γονιδιωματικής (και άλλων μοριακών παραγόντων) και της νόσου αποτελεί σημαντικό μέρος της ανάπτυξης της εξατομικευμένης ιατρικής. Οι φαρμακευτικές εταιρείες αναπτύσσουν ήδη ορισμένα στοχευμένα φάρμακα ως αποτέλεσμα.
Η φιλοσοφία της εξατομικευμένης ιατρικής – Το σωστό φάρμακο στη σωστή δόση για τον σωστό ασθενή
Η εξατομικευμένη ιατρική βασίζεται σε ένα λεπτομερές προφίλ του ατόμου, συμπεριλαμβανομένου του υποπληθυσμού στον οποίο ανήκει ο ασθενής. Ένας γιατρός που παρέχει υπηρεσίες εξατομικευμένης ιατρικής θα μπορεί να χρησιμοποιεί στοχευμένες (στρωματοποιημένες) θεραπείες, αλλά θα λαμβάνει υπόψη του περισσότερα στοιχεία από τον υποπληθυσμό στον οποίο ανήκει ο ασθενής. Ωστόσο, η εξατομικευμένη ιατρική λαμβάνει υπόψη και άλλες πληροφορίες, όπως ο τρόπος ζωής και το περιβάλλον του ατόμου (έκθεση στην υπεριώδη ακτινοβολία, διατροφή, κάπνισμα, άγχος). Αυτό θα βοηθήσει στη λήψη των καλύτερων αποφάσεων σχετικά με τη διαχείριση της νόσου του ασθενούς. Επιπλέον, η απόφαση θα πρέπει να λαμβάνεται από κοινού από το γιατρό και τον ασθενή.
Ένας άλλος τρόπος για να προστεθούν πολύ περισσότερες λεπτομέρειες στο προφίλ ενός ατόμου είναι ο «προσδιορισμός αλληλουχίας ολόκληρου του γονιδιώματος» («whole genome sequencing»), όπου διαφέρει από τον έλεγχο για παραλλαγές σε ένα ή μερικά μόνο γονίδια. Η τεχνική αυτή δεν αποτελεί ακόμη συνήθη κλινική τεχνική, αλλά πολλοί προβλέπουν ότι αυτό θα αλλάξει. Για την καλύτερη κατανόηση των διαφορών μεταξύ των ατόμων, τα γονιδιωματικά δεδομένα πρέπει να ενσωματωθούν με άλλες πληροφορίες για τους ασθενείς, όπως η δομή και οι χημικές τροποποιήσεις του DNA τους (επιγονιδίωμα), το προφίλ των πρωτεϊνών τους (πρωτεώμα), το προφίλ των μεταβολιτών τους (μεταβόλωμα), καθώς και αναλυτικά στοιχεία για τη διατροφή, τον τρόπο ζωής και το περιβάλλον.
Ο προσδιορισμός αλληλουχίας ολόκληρου του γονιδιώματος και άλλες σχετικές τεχνολογίες θα συμβάλουν στην προαγωγή της πραγματικά εξατομικευμένης ιατρικής.
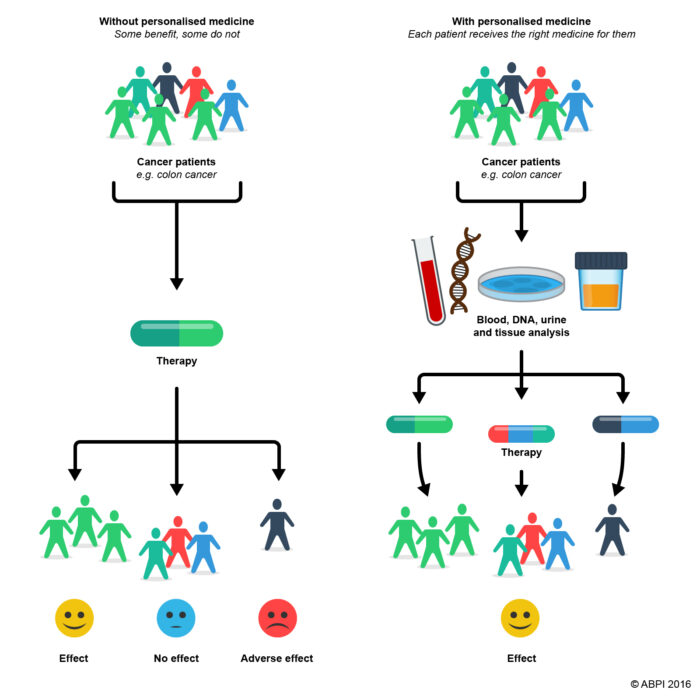
- Example schematic of use of personalised medicine. From ABPI 2016 https://www.abpischools.org.uk/topics/how-medicines-work/personalised-medicine/
Στρωματοποιημένα και εξατομικευμένα φάρμακα
Ίδια συμπτώματα, ίδια ασθένεια, ίδια θεραπεία;
Γενικά πιστεύεται ότι οι ασθενείς που διαγιγνώσκονται με την ίδια ασθένεια παρουσιάζουν την ίδια βασική αιτία. Συχνά λαμβάνουν τις ίδιες θεραπείες. Ωστόσο, η κλινική εμπειρία μας λέει ότι οι ασθενείς δεν ανταποκρίνονται στο σύνολό τους με τον ίδιο τρόπο.
Στην πραγματικότητα, οι ασθενείς που διαγιγνώσκονται με την ίδια νόσο μπορεί να παρουσιάζουν διαφορετικές αιτίες για την εκδήλωσή της. Ως εκ τούτου, έχει μεγάλο ενδιαφέρον να προσπαθήσουμε να αναπτύξουμε φάρμακα ή θεραπείες προσαρμοσμένες σε μια συγκεκριμένη ομάδα ασθενών ή μεμονωμένα άτομα.
Τα προφίλ βιοδεικτών είναι θεμελιώδους σημασίας για τον εντοπισμό ασθενών που μοιράζονται παρόμοια χαρακτηριστικά και επιτρέπουν τη διαστρωμάτωση των ασθενών σε υποομάδες.
Εξατομικευμένη ιατρική [PM]
Η Ευρωπαϊκή Συμμαχία για την Εξατομικευμένη Ιατρική (EAPM) ορίζει την εξατομικευμένη ιατρική (EI) ως "μια στοχευμένη προσέγγιση για την πρόληψη, τη διάγνωση και τη θεραπεία ασθενειών με βάση το ειδικό προφίλ ενός ατόμου". Ο κύριος στόχος της (ΕΙ) είναι η εφαρμογή/χρήση μέτρων/τεχνολογιών για τη θεραπεία του σωστού ασθενούς (δηλαδή της σωστής διάγνωσης) με το σωστό φάρμακο τη σωστή στιγμή.
Η υγεία ενός ατόμου καθορίζεται από τις γενετικές του ιδιαιτερότητες σε συνδυασμό με τον τρόπο ζωής και το περιβάλλον του. Συνδυάζοντας και αναλύοντας τα χαρακτηριστικά των ασθενών, μπορούν να εντοπιστούν προγνωστικά μοντέλα βοηθώντας στον προσδιορισμό του κινδύνου ενός ατόμου να αναπτύξει ασθένεια, στην έγκαιρη ανίχνευση ασθενειών και στον προσδιορισμό των πιο αποτελεσματικών παρεμβάσεων για τη βελτίωση της υγείας, είτε πρόκειται για φάρμακα, είτε για επιλογές τρόπου ζωής, είτε για αλλαγές στη διατροφή.
Η πρόοδος στην κατανόηση της σχέσης μεταξύ της γονιδιωματικής (και άλλων μοριακών παραγόντων) και της νόσου αποτελεί σημαντικό μέρος της ανάπτυξης της εξατομικευμένης ιατρικής.
- European Alliance of Personalised Medicine
Στρωματοποιημένη ιατρική
Η στρωματοποίηση, στο δικό μας πλαίσιο, σημαίνει τον προσδιορισμό υποπληθυσμών (μια ομάδα ή ένα ποσοστό ασθενών) ανάλογα με τον «υπότυπο» της νόσου με τον οποίο έχει διαγνωστεί ένα άτομο. Η διαστρωμάτωση συμβάλλει στον εντοπισμό ασθενών με διαφορετικούς μηχανισμούς νόσου ή την πιθανότητα ιδιαίτερης ανταπόκρισης σε θεραπείες, επιτρέποντας τον προσδιορισμό και την ανάπτυξη θεραπειών που είναι αποτελεσματικές για συγκεκριμένες ομάδες ασθενών.
Ο καρκίνος του μαστού μπορεί να συνδεθεί με τις ορμόνες των οιστρογόνων και της προγεστερόνης. Τα περισσότερα καρκινικά κύτταρα του μαστού διαθέτουν μεγάλο αριθμό μορίων (υποδοχείς) που συνδέονται με τα οιστρογόνα και επιτρέπουν την ανάπτυξη των κυττάρων όταν υπάρχουν οιστρογόνα. Αυτά τα κύτταρα είναι «θετικά στους υποδοχείς οιστρογόνων». Πολλά από αυτά τα κύτταρα αναπτύσσονται επίσης σε απόκριση της παρουσίας της προγεστερόνης. Είναι «θετικά στους υποδοχείς προγεστερόνης». Τα ER- και PR-θετικά κύτταρα ονομάζονται "θετικά κύτταρα ορμονικών υποδοχέων" (Travis, C. R., Key, T. J.:2003).
Τα κύτταρα του καρκίνου του μαστού που είναι θετικά στους υποδοχείς οιστρογόνων ή/και προγεστερόνης είναι πιθανό να ανταποκριθούν σε φάρμακα που εμποδίζουν τη δράση των οιστρογόνων ή της προγεστερόνης. Περίπου 60 σε κάθε 100 ασθενείς με καρκίνο του μαστού ανταποκρίνονται σε αυτά τα φάρμακα. Τα ίδια φάρμακα θα είναι αποτελεσματικά μόνο σε περίπου 5 ή 10 περιπτώσεις στις 100, εάν ο όγκος δεν είναι θετικός στους υποδοχείς οιστρογόνων ή/και προγεστερόνης.
Ορισμένα καρκινικά κύτταρα του μαστού παράγουν επίσης υπερβολικά πολλές πρωτεΐνες που ονομάζονται «Her2/neu». Είναι γνωστά ως «HER-2 θετικά». Αυτοί οι τύποι καρκίνου είναι συνήθως επιθετικοί, καθώς τα κύτταρα τείνουν να αναπτύσσονται πολύ ταχύτερα. Ωστόσο, το φάρμακο τραστουζουμάμπη δεσμεύεται στην πρωτεΐνη Her2/neu. Αυτό βελτιώνει τη συνολική επιβίωση για θετικούς στο γονίδιο HER-2 ασθενείς με καρκίνο του μαστού σε προχωρημένο στάδιο [1].
Ορισμένοι τύποι καρκίνου του μαστού δεν είναι θετικοί ούτε στους υποδοχείς οιστρογόνων, ούτε στους υποδοχείς προγεστερόνης ή στο γονίδιο HER-2. Αυτοί οι όγκοι ονομάζονται «τριπλά αρνητικοί», και μέχρι στιγμής δεν υπάρχουν διαθέσιμες στοχευμένες θεραπείες. Ως εκ τούτου, συνταγογραφούνται πιο συνηθισμένοι τύποι χημειοθεραπείας.
Η στρωματοποιημένη ιατρική έχει αναπτυχθεί αρκετά στον τομέα του καρκίνου, αλλά υπάρχουν πολλά κενά σε άλλες ασθένειες (π.χ. νευρολογικές ασθένειες), ιδίως εάν η αιτία της νόσου είναι πολυπαραγοντική και όχι μόνο γενετική.
Συχνά οι όροι "εξατομικευμένη ιατρική" και "στρωματοποιημένη ιατρική" χρησιμοποιούνται ως εναλλακτικοί. Ο παρακάτω πίνακας παρουσιάζει τις βασικές διαφορές μεταξύ αυτών των 2 όρων:
| Εξατομικευμένη ιατρική | Στρωματοποιημένη ιατρική |
|---|---|
| Στοχεύει στη χρήση μέτρων για τη θεραπεία του σωστού ασθενούς με τη σωστή δόση τη σωστή στιγμή. Η Εξατομικευμένη Ιατρική χρησιμοποιεί στοχευμένα φάρμακα λαμβάνοντας υπόψη άλλες ατομικές πληροφορίες για να προσαρμόσει τη θεραπεία και τη διαχείριση του ασθενούς στην ιδιαίτερη κατάστασή του. Εφαρμόζεται με σκοπό να εξασφαλιστεί το καλύτερο αποτέλεσμα και να μειωθεί ο κίνδυνος παρενεργειών. | Πρόκειται για τη χρήση ενός φαρμάκου που απευθύνεται σε έναν υποπληθυσμό ασθενών (μια ομάδα ή ένα ποσοστό ασθενών, π.χ. με συγκεκριμένη νόσο, ηλικιακή ομάδα ή στάδιο νόσου), αντί να χρησιμοποιείται ένα φάρμακο για τη θεραπεία όλων των ασθενών που πάσχουν από τη συγκεκριμένη νόσο. |
Πίνακας 1: Στρωματοποιημένα και εξατομικευμένα φάρμακα. Εργαλειοθήκη EUPATI
Τα εξατομικευμένα και στρωματοποιημένα φάρμακα αποκτούν ολοένα και μεγαλύτερη απήχηση και οι προσεγγίσεις τους έχουν εφαρμοστεί ευρέως στις θεραπείες του καρκίνου και των σπάνιων ασθενειών, όπου υπάρχει πληθώρα διαθέσιμων πληροφοριών σχετικά με τα γενετικά αίτια της νόσου (Verma:2012). Αναμένεται ότι οι προσεγγίσεις αυτές θα χρησιμοποιούνται όλο και περισσότερο στην ανάπτυξη θεραπειών και για άλλες ασθένειες. Πρόκειται για μια σημαντική αλλαγή στην προσέγγιση της θεραπείας των ασθενών με βάση την υποκείμενη αιτία της συγκεκριμένης νόσου τους. Παρόλο που οι άνθρωποι μπορεί να διαγιγνώσκονται με την ίδια ασθένεια, η κλινική εμπειρία δείχνει ότι οι άνθρωποι μπορεί να ανταποκρίνονται διαφορετικά στην ίδια θεραπεία:
- ορισμένοι θα ανταποκριθούν ικανοποιητικά
- ορισμένοι δεν θα ανταποκριθούν, αλλά όχι στο ίδιο επίπεδο με άλλους
- ορισμένοι δεν θα ανταποκριθούν καθόλου
- ορισμένοι μπορεί να έχουν σοβαρές παρενέργειες (ανεπιθύμητες ενέργειες)
- ορισμένοι μπορεί να αναπτύξουν «αντίσταση» στο φάρμακο (σταματούν να ανταποκρίνονται), ακόμη και αν ανταποκρίθηκαν ικανοποιητικά στην αρχή
Κατά τη θεραπεία ενός ασθενούς, οι γιατροί προσπαθούν να λαμβάνουν υπόψη τους διάφορους κλινικούς παράγοντες και παράγοντες του τρόπου ζωής των ασθενών. Ωστόσο, συχνά η μόνη επιλογή είναι η δοκιμή μιας θεραπείας, η παρακολούθηση της ανταπόκρισης του ασθενούς και η αλλαγή της δόσης, του προγράμματος ή του φαρμάκου, εάν είναι απαραίτητο. Είναι πλέον γνωστό ότι οι ασθένειες αυτών των ασθενών οφείλονται σε διαφορετικές αιτίες. Με άλλα λόγια, τα ίδια συμπτώματα που παρουσιάζουν οι ασθενείς μπορεί να οφείλονται σε διαφορετικές διεργασίες που συμβαίνουν στα κύτταρά τους (έχουν διαφορετική υποκείμενη παθολογία, διαφορετικούς γονιδιωματικούς και γενετικούς παράγοντες κ.λπ.). Αυτές οι διαφορές μπορεί να έχουν μεγάλο αντίκτυπο στον τρόπο με τον οποίο εξελίσσεται μια ασθένεια και στον τρόπο με τον οποίο ένα άτομο ανταποκρίνεται σε μια συγκεκριμένη θεραπεία.
Βιοδείκτες
Διαδικασίες που λαμβάνουν χώρα σε κυτταρικό και μοριακό επίπεδο μπορούν να μετρηθούν με τη χρήση «βιοδεικτών». Οι βιοδείκτες αποτελούν βασικά εργαλεία για να καταστεί δυνατή η Εξατομικευμένη Ιατρική, για παράδειγμα, η επιλογή των κατάλληλων ασθενών για θεραπεία με προσαρμοσμένα (στις ανάγκες τους) φάρμακα.
Η λέξη βιοδείκτες εδώ αναφέρεται σε έναν βιολογικό δείκτη, κάτι που μπορεί να μετρηθεί και υποδεικνύει την παρουσία μιας ασθένειας, μιας φυσιολογικής αλλαγής, μιας ανταπόκρισης σε μια θεραπεία ή μιας ψυχολογικής κατάστασης.
Για παράδειγμα, τα επίπεδα γλυκόζης χρησιμοποιούνται ως βιοδείκτης στη διαχείριση του διαβήτη και οι εικόνες του εγκεφάλου μπορούν να παρέχουν πληροφορίες σχετικά με την εξέλιξη της σκλήρυνσης κατά πλάκας [2].
Οι βιοδείκτες χρησιμοποιούνται σε πολλούς επιστημονικούς τομείς. Χρησιμοποιούνται με διαφορετικούς τρόπους σε διάφορα στάδια της ανάπτυξης φαρμάκων, μεταξύ άλλων σε ορισμένες περιπτώσεις ως υποκατάστατο καταληκτικό σημείο για την ένδειξη και τη μέτρηση της επίδρασης παρεμβάσεων, όπως τα φάρμακα, σε κλινικές δοκιμές.
Για παράδειγμα, τα επίπεδα αιμοσφαιρίνης έχουν χρησιμοποιηθεί σε δοκιμές φάσης ΙΙΙ για την υποστήριξη της ανάπτυξης θεραπειών για τη νόσο Gaucher τύπου 1 (μια σπάνια ασθένεια που επηρεάζει πολλαπλά συστήματα οργάνων και μειώνει το προσδόκιμο ζωής, αλλά μπορεί να χρειαστούν χρόνια για να εμφανιστούν αλλαγές στα κλινικά συμπτώματα) [3].
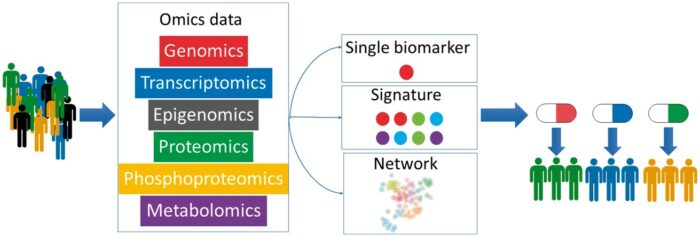
Οι βιοδείκτες που χρησιμοποιούνται για τη Εξατομικευμένη Ιατρική αποτελούν μέρος ενός σχετικά νέου κλινικού εργαλείου. Πολύπλοκες υπογραφές βιοδεικτών μπορεί να είναι το αποτέλεσμα της ενσωμάτωσης δεδομένων multi-omics.
Κατηγοριοποιούνται με διάφορους τρόπους ανάλογα με τις κλινικές τους εφαρμογές. Οι βιοδείκτες έχουν κλινικό ρόλο στον περιορισμό ή την καθοδήγηση των θεραπευτικών αποφάσεων. Μερικά παραδείγματα βιοδεικτών είναι τα εξής:
- Φυσιολογικές μετρήσεις όπως η αρτηριακή πίεση ή η θερμοκρασία.
- Βιολογικές ουσίες («βιοχημικά προϊόντα»), όπως ένζυμα ή ορμόνες.
- Γονιδιακές αλλαγές.
- Εικόνες από την απεικόνιση μαγνητικού συντονισμού (MRI)
Multi-omics τεχνολογίες
Οι τεχνολογίες multi-omics χρησιμοποιούνται για την ανάλυση βιολογικών διεργασιών που λαμβάνουν χώρα σε διαφορετικά επίπεδα, όπως στο επίπεδο του DNA (γονιδίωμα) και της τροποποίησης του DNA (επιγονιδίωμα), στο επίπεδο του RNA (μεταγράφωμα), στο επίπεδο των πρωτεϊνών (πρωτέωμα) και των μεταβολιτών (μεταβόλωμα).
Συνδυάζοντας αυτά, οι επιστήμονες μπορούν να αναλύουν πολύπλοκα βιολογικά δεδομένα για την καλύτερη κατανόηση ασθενειών και τον εντοπισμό βιοδεικτών.
Γονιδιωματική
Η τρέχουσα έρευνα καταδεικνύει σημαντικά στοιχεία για τις ασθένειες σε κυτταρικό και μοριακό επίπεδο. Υπάρχουν ενδείξεις ότι συγκεκριμένες αλλαγές στα γονίδια (παραλλαγές) μπορούν να επηρεάσουν τον τρόπο λειτουργίας των κυττάρων και τον τρόπο με τον οποίο μπορεί να εκδηλωθεί μια ασθένεια. Ασθένειες με παρόμοια συμπτώματα μπορεί να διαγνωστούν ως η ίδια ασθένεια. Ωστόσο, μπορεί να οφείλονται σε διαφορετικές γενετικές παραλλαγές.
Μεταγραφομική
Η μεταγραφομική είναι η μελέτη του μεταγραφώματος - του πλήρους συνόλου των μεταγράφων RNA που παράγονται από το γονιδίωμα, υπό συγκεκριμένες συνθήκες ή σε ένα συγκεκριμένο κύτταρο - χρησιμοποιώντας μεθόδους υψηλής απόδοσης, όπως η ανάλυση μικροσυστοιχιών. Η σύγκριση των μεταγραφωμάτων επιτρέπει τον εντοπισμό γονιδίων που εκφράζονται διαφορετικά σε διαφορετικούς κυτταρικούς πληθυσμούς ή σε απόκριση σε διαφορετικές θεραπείες.
Επιγονιδιωματική
Αυτός ο αναπτυσσόμενος τομέας μας βοηθά να κατανοήσουμε τη διακύμανση των ασθενειών. Οι μελέτες διδύμων αποκάλυψαν πώς άτομα με το ίδιο γονιδιωματικό υπόβαθρο μπορούν να έχουν διαφορετικό επίπεδο επικινδυνότητας για μια συγκεκριμένη ασθένεια. Αυτό μπορεί να εξηγηθεί από την επιγενετική. Η επιγενετική είναι η μελέτη του τρόπου με τον οποίο τα γονίδια μπορούν να ενεργοποιηθούν ή να απενεργοποιηθούν ή να ρυθμιστούν (να αυξηθούν ή να μειωθούν) χωρίς αλλαγές στην αλληλουχία του DNA τους. Οι επιγενετικές αλλαγές μπορεί να επηρεάσουν τον τρόπο με τον οποίο ένας ασθενής ανταποκρίνεται <3567>στη θεραπεία, δεδομένου ότι οι αλλαγές μπορεί να προκύψουν ως απόκριση σε περιβαλλοντικούς παράγοντες ή παράγοντες του τρόπου ζωής, όπως η έκθεση στην υπεριώδη ακτινοβολία, η διατροφή, το κάπνισμα ή το στρες. Τελικά, ένα εξατομικευμένο φάρμακο θα λαμβάνει υπόψη τα επιγενετικά χαρακτηριστικά ενός ατόμου.
Πρωτεομική
Η πρωτεομική είναι η μεγάλης κλίμακας μελέτη των πρωτεωμάτων. Πρωτέωμα είναι το σύνολο των πρωτεϊνών που παράγονται σε έναν οργανισμό, ένα σύστημα ή ένα βιολογικό πλαίσιο, για παράδειγμα, το πρωτέωμα ενός είδους (για παράδειγμα, του Homo sapiens) ή ενός οργάνου (για παράδειγμα, του ήπατος). Το πρωτεώμα δεν είναι σταθερό- διαφέρει από κύτταρο σε κύτταρο και αλλάζει με την πάροδο του χρόνου. Σε κάποιο βαθμό, το πρωτεώμα αντικατοπτρίζει το υποκείμενο μεταγράφωμα. Ωστόσο, η πρωτεϊνική δραστηριότητα διαμορφώνεται επίσης από πολλούς παράγοντες εκτός από το επίπεδο έκφρασης του σχετικού γονιδίου.
Η Πρωτεομική χρησιμοποιείται για τη διερεύνηση:
- της χρονικής και τοπικής έκφρασης πρωτεϊνών,
- των ρυθμών παραγωγής και αποδόμησης των πρωτεϊνών και των επίπεδων σταθερής κατάστασης,
- του τρόπου τροποποίησης των πρωτεϊνών,
- της μετακίνησης πρωτεϊνών μεταξύ υποκυτταρικών διαμερισμάτων,
- της συμμετοχής των πρωτεϊνών στα μεταβολικά μονοπάτια,
- του τρόπου αμοιβαίας αλληλεπίδρασης των πρωτεϊνών.
Η πρωτεομική μπορεί να παρέχει σημαντικές βιολογικές πληροφορίες για πολλά βιολογικά προβλήματα, όπως:
- ποιες πρωτεΐνες αλληλεπιδρούν με μια συγκεκριμένη πρωτεΐνη ενδιαφέροντος,
- ποιες πρωτεΐνες εντοπίζονται σε ένα υποκυτταρικό διαμέρισμα,
- ποιες πρωτεΐνες εμπλέκονται σε μια βιολογική διαδικασία.
Μεταβολομική
Η μεταβολομική είναι η μεγάλης κλίμακας μελέτη μικρών μορίων, κοινώς γνωστών ως μεταβολιτών, εντός κυττάρων, βιορευστών, ιστών ή οργανισμών. Συλλογικά, αυτά τα μικρά μόρια και οι αλληλεπιδράσεις τους εντός ενός βιολογικού συστήματος είναι γνωστά ως μεταβολισμός.
Όπως η γονιδιωματική είναι η μελέτη του DNA και των γενετικών πληροφοριών μέσα σε ένα κύτταρο και η μεταγραφομική είναι η μελέτη του RNA και των διαφορών στην έκφραση του mRNA, έτσι και η μεταβολομική είναι η μελέτη των υποστρωμάτων και των προϊόντων του μεταβολισμού, τα οποία επηρεάζονται τόσο από γενετικούς όσο και από περιβαλλοντικούς παράγοντες. Η μεταβολομική είναι μια ισχυρή προσέγγιση επειδή οι μεταβολίτες και οι συγκεντρώσεις τους, σε αντίθεση με άλλες "omics" μετρήσεις, αντικατοπτρίζουν άμεσα την υποκείμενη βιοχημική δραστηριότητα και την κατάσταση των κυττάρων/ιστών.
Φαρμακογενετική ή φαρμακογονιδιωματική
Ένας τύπος βιοδείκτη που χρησιμοποιείται ευρέως είναι οι γενετικές ή γονιδιωματικές πληροφορίες ενός ατόμου. Η μελέτη του τρόπου με τον οποίο η γενετική και η γονιδιωματική επηρεάζουν την απόκριση ενός ατόμου σε μια θεραπεία είναι γνωστή ως φαρμακογενετική και φαρμακογονιδιωματική. Αυτά βοηθούν στην «προσαρμογή μιας θεραπείας» σύμφωνα με τη γενετική διαμόρφωση ενός ατόμου. Ορισμένα φάρμακα που κυκλοφορούν σήμερα στην αγορά απαιτούν γενετικό έλεγχο πριν από τη συνταγογράφησή τους, προκειμένου να διασφαλιστεί ότι η θεραπεία είναι ασφαλής για τον εκάστοτε ασθενή. Για παράδειγμα:
Οι ασθενείς με HIV ελέγχονται για μια γενετική παραλλαγή γνωστή ως «HLA B*5701» πριν από τη συνταγογράφηση του φαρμάκου abacavir, επειδή η παραλλαγή αυτή σχετίζεται με μια ανεπιθύμητη αντίδραση στο φάρμακο.
Επιπλέον, οι πληροφορίες που παρέχονται με ορισμένα άλλα φάρμακα που κυκλοφορούν στην αγορά ενημερώνουν τους γιατρούς για τον τρόπο χρήσης των γονιδιωματικών πληροφοριών ενός ασθενούς όταν συνταγογραφούν το φάρμακο. Οι γονιδιωματικές πληροφορίες μπορούν να βοηθήσουν να αποφασιστεί αν το συγκεκριμένο φάρμακο είναι η καλύτερη επιλογή για τον συγκεκριμένο ασθενή και ποια θα είναι η ιδανική δόση.
Για παράδειγμα:
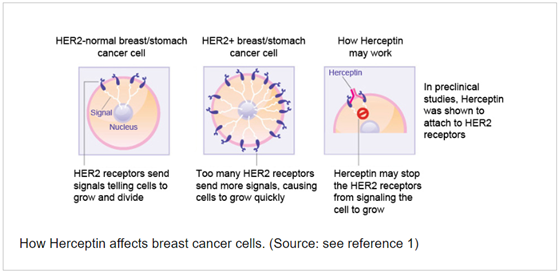
Η τραστουζουμάμπη (Herceptin) είναι μονοκλωνικό αντίσωμα με γονιδιακή στόχευση που στρέφεται κατά του υποδοχέα 2 (ΗΕR-2) του ανθρώπινου επιδερμικού αυξητικού παράγοντα και έχει εγκριθεί για τη θεραπεία του καρκίνου του μαστού σε πρώιμο στάδιο. Το HER-2 υπερεκφράζεται σε περίπου 20% των καρκίνων του μαστού, προκαλώντας υπερβολική σηματοδότηση στο εσωτερικό των κυττάρων με αποτέλεσμα τα καρκινικά κύτταρα του μαστού να αναπτύσσονται όλο και ταχύτερα. Το HER-2 υπάρχει στην επιφάνεια ορισμένων καρκινικών κυττάρων του μαστού και διοχετεύεται εντός της κυτταρικής μεμβράνης. Μόνο οι ασθενείς που έχουν βρεθεί θετικοί για υψηλά επίπεδα HER-2 θα ωφεληθούν από τη θεραπεία με τραστουζουμάμπη. Η τραστουζουμάμπη δρα προσκολλώντας στο HER-2 στην επιφάνεια των καρκινικών κυττάρων του μαστού και εμποδίζοντάς τα να λαμβάνουν σήματα ανάπτυξης. Μπλοκάροντας τα σήματα, η τραστουζουμάμπη μπορεί να επιβραδύνει ή να σταματήσει την ανάπτυξη του καρκίνου του μαστού και αποτελεί παράδειγμα στοχευμένης ανοσοθεραπείας.
- Figure 3. How Herceptin affects breast cancer cells
Βιοδείκτες και ανάπτυξη φαρμάκων
Για τη δημιουργία στοχευμένων θεραπειών, οι βιοδείκτες χρησιμοποιούνται ολοένα και περισσότερο στην ανάπτυξη φαρμάκων. Αυτό αναμένεται να:
- βελτιώσει τα αποτελέσματα για τους ασθενείς: οι γιατροί θα πρέπει να είναι σε θέση να επιλέγουν φάρμακα που λειτουργούν καλά για κάθε άτομο και με χαμηλότερο κίνδυνο σοβαρών παρενεργειών
- βελτιώσει την αποδοτικότητα της ανάπτυξης φαρμάκων, καθιστώντας τις μη κλινικές και κλινικές δοκιμές πιο αποτελεσματικές, λιγότερο χρονοβόρες και ασφαλέστερες
Μετά τον εντοπισμό ενός βιοδείκτη για μια συγκεκριμένη κατάσταση, πρέπει να περάσει από την πειραματική και αναλυτική επικύρωση. Η πειραματική επικύρωση επιτρέπει την ανάπτυξη του πλέον προσαρμοσμένου πρωτοκόλλου για τη συστηματική χρήση του βιοδείκτη. Η αναλυτική επικύρωση είναι ένα από τα πιο σημαντικά βήματα, χρησιμεύει για τον προσδιορισμό των ειδικών χαρακτηριστικών του υποψήφιου βιοδείκτη πριν από την ανάπτυξη μιας δοκιμασίας ρουτίνας. Εξετάζονται διάφορες παράμετροι, συμπεριλαμβανομένης της ευαισθησίας, της εξειδίκευσης, της ανθεκτικότητας, της εγκυρότητας, της αξιοπιστίας, κ.λπ. Στη συνέχεια, η τυποποίηση του πρωτοκόλλου βελτιστοποιεί το επικυρωμένο πρωτόκολλο για συστηματική χρήση, συμπεριλαμβανομένης της ανάλυσης των κρίσιμων σημείων με σάρωση ολόκληρης της διαδικασίας για τον εντοπισμό και τον έλεγχο των πιθανών κινδύνων.
- Proteomics and phosphoproteomics in precision medicine applications and challenges
Ανάπτυξη φαρμάκων και Εξατομικευμένη Ιατρική
Εξατομικευμένη ιατρική και βιομηχανία
Οι φαρμακευτικές εταιρείες έχουν ήδη αρχίσει να παράγουν στοχευμένα φάρμακα. Πολλοί έχουν αφοσιωθεί στην ιδέα της εξατομικευμένης θεραπείας, ιδίως στην ογκολογία. Ωστόσο, η Εξατομικευμένη Ιατρική παρουσιάζει ευκαιρίες και προκλήσεις, επιτρέποντας ουσιαστικές κλινικές προόδους και ταχύτερα χρονοδιαγράμματα ανάπτυξης φαρμάκων. Το κόστος μπορεί να αυξηθεί λόγω της πολυπλοκότητας της ανάλυσης βιοδεικτών και της διαγνωστικής διαδικασίας. Οι βιοδείκτες πρέπει να είναι επικυρωμένοι και αξιόπιστοι, γεγονός που απαιτεί νέες ικανότητες στο σχεδιασμό δοκιμών, την ανάλυση δεδομένων και την εμπειρογνωμοσύνη των ερευνητών στη συλλογή και διαχείριση δειγμάτων. Επιπλέον, απαιτείται μεγαλύτερη στατιστική και υπολογιστική ικανότητα για την εξόρυξη δεδομένων με σκοπό την καλύτερη κατανόηση των σχέσεων μεταξύ γενετικών, βιολογικών και περιβαλλοντικών παραγόντων. Για το λόγο αυτό, η φαρμακοβιομηχανία και οι ενδιαφερόμενοι φορείς - ακαδημαϊκοί, ρυθμιστικοί οργανισμοί, χρηματοδότες και φορείς χάραξης πολιτικής - θα πρέπει να δεσμευτούν να συνεργαστούν.
Συνοδοί διάγνωσης
O Συνοδός διάγνωσης είναι μια ιατρική συσκευή, συχνά συσκευή in vitro, η οποία παρέχει πληροφορίες που είναι απαραίτητες για την ασφαλή και αποτελεσματική χρήση ενός αντίστοιχου φαρμάκου ή βιολογικού προϊόντος. Οι συνοδοί διάγνωσης είναι απαραίτητες εξετάσεις για την επιλογή των ασθενών πριν από τη χορήγηση ενός φαρμάκου. Μπορούν να κάνουν τα εξής:
- Να δείξουν ποιοι είναι πιθανό να ανταποκριθούν στο φάρμακο («ανταποκρινόμενοι» και «μη ανταποκρινόμενοι»),
- Να εντοπίσουν ασθενείς που διατρέχουν υψηλό κίνδυνο για ανεπιθύμητες ενέργειες,
- Να βοηθήσουν τον γιατρό να επιλέξει μια κατάλληλη δόση που να είναι ασφαλής και αποτελεσματική.
Εξατομικευμένες προσεγγίσεις στην κλινική πράξη: η σημασία των συνοδών διάγνωσης
Όλο και συχνότερα, τα νέα φάρμακα εγκρίνονται μαζί με μια συνοδευτική διαγνωστική εξέταση για να διασφαλιστεί ότι το φάρμακο είναι κατάλληλο για τον ασθενή που πρόκειται να αντιμετωπιστεί θεραπευτικά. Εάν μια διαγνωστική εξέταση δεν έχει επικυρωθεί σωστά, δεν θα είναι σε θέση να εντοπίσει τον κατάλληλο ασθενή που θα μπορούσε να επωφεληθεί από αυτό το φάρμακο ή ο ασθενής μπορεί να εμφανίσει παρενέργειες λόγω της θεραπείας του με μη βέλτιστο φάρμακο. Επομένως, ο σωστός σχεδιασμός και η επικύρωση της διαγνωστικής εξέτασης είναι ουσιαστικής σημασίας για την επίτευξη του βέλτιστου αποτελέσματος του φαρμάκου, καθώς και για τον ασθενή.
Οι συνοδοί διάγνωσης μπορεί να περιλαμβάνουν εξετάσεις απευθείας στον ασθενή, όπως ηλεκτροκαρδιογράφημα (ΗΚΓ) ή διαγνωστική απεικόνιση όπως απεικόνιση μαγνητικού συντονισμού (MRI). Οι ρυθμιστικές αρχές θεωρούν γενικά ότι οι εξετάσεις που διενεργούνται σε δείγματα που ελήφθησαν από έναν ασθενή (όπως οι εξετάσεις DNA) παρέχουν τα πιο έγκυρα τεκμήρια.
Οι συνοδοί διάγνωσης πρέπει να έχουν «προβλεπόμενη χρήση» ή «ενδείξεις για τη χρήση». Συχνά αναφέρονται και τα δύο υπό τον γενικό όρο «προβλεπόμενη χρήση» (μιας θεραπείας). Γενικά, θα πρέπει να περιλαμβάνουν τα ακόλουθα στοιχεία:
- Τον πληθυσμό-στόχο για τον οποίο προορίζεται η εξέταση (όπως άτομα με συγκεκριμένους γονότυπους (γενετική σύνθεση) ή φαινότυπους (χαρακτηριστικά)).
- Τον λόγο για τον οποίο πραγματοποιείται η μέτρηση - ο «κλινικός σκοπός» (όπως, για παράδειγμα, για να βοηθήσει στη διάγνωση, στην εκτίμηση της πιθανής εξέλιξης της νόσου (πρόγνωση) και στην παρακολούθηση).
- Τι μετράται, προσδιορίζεται ή ανιχνεύεται (όπως ένα συγκεκριμένο γονίδιο ή μια πρωτεΐνη).
- Τι είδους μέτρηση πραγματοποιείται κατά την εξέταση, συμπεριλαμβανομένου του εάν η εξέταση είναι ποιοτική (εξετάζει παρατηρήσεις και περιγραφές), ή ημιποσοτική και ποσοτική (εξετάζει αριθμούς).
- Το είδος του δείγματος και από πού έχει ληφθεί (π.χ. ολικό αίμα, εγκεφαλονωτιαίο υγρό).
- Το περιβάλλον στο οποίο προορίζεται να χρησιμοποιηθεί η διαγνωστική συσκευή (σε εργαστήριο ή σε «χώρο περίθαλψης») και το είδος του εξοπλισμού που απαιτείται για τη διενέργεια της δοκιμής.
- Την κατάσταση-στόχο (μια συγκεκριμένη ασθένεια, στάδιο ασθένειας, κατάσταση υγείας ή οποιαδήποτε άλλη αναγνωρίσιμη κατάσταση ή συμβάν).
Προκλήσεις και προοπτικές στην εξατομικευμένη ιατρική
Η θεραπεία των ασθενών με εξατομικευμένη ιατρική θα απαιτήσει την ανάπτυξη στοχευμένων φαρμάκων.
Για να σημειώσει πρόοδο η εξατομικευμένη ιατρική, τα νέα ευρήματα της μοριακής έρευνας και οι νέες τεχνολογίες (όπως οι τεχνολογίες «-ωματικής») πρέπει να «μεταγραφούν» (προσαρμοστούν) για χρήση στην ανάπτυξη φαρμάκων και στην εγκεκριμένη θεραπεία.
Ωστόσο, ένα πλεονέκτημα της ανάπτυξης στοχευμένων φαρμάκων είναι η αύξηση της αποτελεσματικότητας των κλινικών δοκιμών. Λιγότερα νέα φάρμακα θα αποτυγχάνουν σε κάθε στάδιο της διαδικασίας ανάπτυξης εάν στοχεύουν σε μια γνωστή αιτία της νόσου και η χρήση βιοδεικτών θα έχει κεντρικό ρόλο στην εξατομικευμένη ιατρική. Η επικύρωση των βιοδεικτών ως μοναδικών και προγνωστικών στοιχείων για την έκβαση της θεραπείας πρέπει να πραγματοποιηθεί πριν από την έγκριση των φαρμάκων που αναπτύσσονται με αυτόν τον τρόπο για διάθεση στην αγορά.
Βιοτράπεζες
Οι μελέτες που αξιοποιούν βιοτράπεζες είναι ιδιαίτερα σημαντικές για την ανάπτυξη της εξατομικευμένης ιατρικής. Οι βιοτράπεζες χρησιμοποιούνται ολοένα και περισσότερο σε κλινικές δοκιμές για νέα φάρμακα. Βασικά, οι βιοτράπεζες είναι μεγάλα, οργανωμένα σύνολα δειγμάτων αίματος ή/και ιστών που δωρίζονται από ασθενείς και υγιείς εθελοντές. Περιλαμβάνουν επίσης δεδομένα που έχουν συλλεχθεί με προσοχή και σχετίζονται με την κλινική κατάσταση των δοτών, τον τρόπο ζωής (διατροφή, κάπνισμα κ.λπ.) και άλλους παράγοντες. Οι βιοτράπεζες επιτρέπουν τη μελέτη των κυττάρων και των μορίων μεγάλου αριθμού δειγμάτων και τη σύνδεση των πληροφοριών αυτών με κλινικά και άλλα δεδομένα. Ο συνδυασμός των πληροφοριών με αυτόν τον τρόπο μας βοηθά να κατανοήσουμε γιατί τα άτομα διαφέρουν:
- στις ασθένειες που παρουσιάζουν,
- στο βαθμό σοβαρότητα των ασθενειών τους και,
- στον τρόπο με τον οποίο ανταποκρίνονται στη θεραπεία.
Όσο περισσότερα δείγματα είναι διαθέσιμα, τόσο πιο αποτελεσματικές μπορούν να είναι τέτοιου είδους μελέτες.
Σε πολλές χώρες δημιουργούνται βιοτράπεζες. BBMRI-ERIC είναι μια ευρωπαϊκή ερευνητική υποδομή για τις βιοτράπεζες. Συγκεντρώνουν όλους τους κύριους παράγοντες του πεδίου των βιοτραπεζών - ερευνητές, βιοτράπεζες, βιομηχανία και ασθενείς - για την ενίσχυση της βιοϊατρικής έρευνας. Για το σκοπό αυτό, προσφέρουν υπηρεσίες διαχείρισης ποιότητας, υποστήριξη σε ηθικά, νομικά και κοινωνικά ζητήματα, καθώς και μια σειρά από διαδικτυακά εργαλεία και λύσεις λογισμικού. Η "EuroBioBank" είναι ένα παράδειγμα διασύνδεσης βιοτραπεζών από διάφορες χώρες, ώστε να είναι διαθέσιμα ακόμη περισσότερα δεδομένα για την έρευνα (στην προκειμένη περίπτωση, για σπάνιες ασθένειες).
Μετάφραση εξατομικευμένων προσεγγίσεων σε κλινικό περιβάλλον: οι προκλήσεις των ασθενών και των γιατρών
Δεοντολογικές προκλήσεις
Υπάρχουν ιδιαίτερες δεοντολογικές προκλήσεις για τους ερευνητές που εργάζονται με προσωπικά δεδομένα. Είναι σημαντικό να λαμβάνουν υπόψη την προστασία του απορρήτου και τη διατήρηση της εμπιστευτικότητας των δεδομένων (βλέπε GDPR), καθώς και να διασφαλίζουν ότι οι συμμετέχοντες σε δοκιμές κατανοούν τι είναι αυτό στο οποίο συμφωνούν (συγκατάθεση κατόπιν ενημέρωσης). Βλέπε επίσης EUPATI Open Classroom, Ενότητα 3, "Μη κλινική ανάπτυξη" Μάθημα 3 Βιβλίο - Περιορισμοί, προκλήσεις και δεοντολογία.
Εμπειρία ασθενών
Η εξατομικευμένη ιατρική ξεκινά από τον ασθενή. Η εξατομικευμένη ιατρική μπορεί να παρέχει πολύ περισσότερες πληροφορίες σχετικά με την υγεία ενός ατόμου, έχοντας έτσι προσωπική επίδραση και αλλάζοντας ενδεχομένως τον τρόπο ζωής του ασθενούς. Πρόκειται, ωστόσο, για έναν πολύπλοκο επιστημονικό κλάδο, και για να μπορούν οι ασθενείς να λαμβάνουν τεκμηριωμένες αποφάσεις για θέματα που σχετίζονται με την υγεία, είναι ζωτικής σημασίας να έχουν τις απαραίτητες γνώσεις. Με άλλα λόγια, οι ασθενείς πρέπει να "ενδυναμωθούν" ώστε να γίνουν συμμέτοχοι στη δική τους υγειονομική περίθαλψη. Είναι οι ασθενείς έτοιμοι γι' αυτό; Και είναι οι επαγγελματίες υγείας αρκετά καταρτισμένοι και έτοιμοι να επικοινωνήσουν με τους ασθενείς τους σχετικά με αυτό;
Με την εξατομικευμένη ιατρική, ο ασθενής που πάσχει από μια νόσο θα λαμβάνει πληροφορίες πριν από τη θεραπεία που θα διασφαλίζουν ότι:
- ένα φάρμακο είναι πιθανόν να λειτουργήσει καλά για εκείνον, και
- δεν υπάρχουν πολλές πιθανότητες να υποφέρει από παρενέργειες με μια συγκεκριμένη θεραπεία.
Όταν οι παρενέργειες είναι αναπόφευκτες, η καλύτερη επίγνωση σχετικά με αυτές και το πόσο σοβαρές μπορεί να είναι θα διευκολύνει τον ασθενή να αποφασίσει και να προγραμματίσει τη θεραπεία, και να την εντάξει στην καθημερινή ζωή του.
Επικοινωνία ασθενούς-ιατρού
Γενικά, με την εξατομικευμένη ιατρική μπορεί να υπάρχουν περισσότερες ή διαφορετικές πληροφορίες σχετικά με τις διαθέσιμες επιλογές θεραπείας για να κατανοήσουν και να συζητήσουν ο ασθενής και ο γιατρός. Οι ασθενείς που δεν είναι εξοικειωμένοι με τη Εξατομικευμένη Ιατρική μπορεί να χρειάζονται πρόσθετη υποστήριξη από τον γιατρό τους για να διασφαλίσουν ότι κατανοούν τις πληροφορίες και μπορούν να λάβουν τεκμηριωμένη απόφαση.
Μπορεί να είναι απαραίτητη η διεξαγωγή περισσότερων εξετάσεων από το συνηθισμένο προκειμένου να καταστεί δυνατή η εξατομικευμένη ιατρική. Οι εξετάσεις αίματος θεωρούνται γενικά εξετάσεις ρουτίνας, αλλά οι βιοψίες (όπου αφαιρούνται κομμάτια ιστού) απαιτούν αναισθησία και η ανάλυση μπορεί να απαιτήσει περισσότερο χρόνο. Οι ασθενείς και οι γιατροί τους θα πρέπει να συζητήσουν τα πλεονεκτήματα και τα μειονεκτήματα κατά τη λήψη των αποφάσεων σχετικά με τις εξετάσεις. Η συζήτηση αυτή θα βοηθήσει στη λήψη της κατάλληλης απόφασης για τον ασθενή.
Εάν μια εξέταση προβλέπει πόσο πιθανό είναι να ανταποκριθεί ένας ασθενής σε ένα φάρμακο, το αποτέλεσμα θα μπορούσε να εκφραστεί, για παράδειγμα, ως «πιθανότητα» (1 στις 3) ή ως ποσοστό (33%). Οι άνθρωποι ερμηνεύουν τον κίνδυνο με διαφορετικούς τρόπους και οι γιατροί θα πρέπει να τους υποστηρίξουν κατά την ερμηνεία των κινδύνων.
Περαιτέρω πόροι
- Genomics England
- Nuffield Council on Bioethics (2010). Medical profiling and online medicine: the ethics of ‘personalised healthcare’ in a consumer age.
- Corpet, A. & Almouzni, G. (Δεκέμβριος 2006-Ιανουάριος 2007). Sciences et Avenir em, 149
- "The Case for Personalized Medicine"(PDF). Συμμαχία για την Εξατομικευμένη Ιατρική. 2014
- Smith R (15 Οκτωβρίου 2012). "Stratified, personalised, or precision medicine". British Medical Journal.
- Jackson and Chester “Personalised cancer medicine” DOI: 10.1002/ijc.28940
- ΕΥΡΩΠΑΪΚΗ ΣΥΜΜΑΧΙΑ ΓΙΑ ΤΗΝ ΕΞΑΤΟΜΙΚΕΥΜΕΝΗ ΙΑΤΡΙΚΗ: https://www.euapm.eu/
Συνημμένα
Παραπομπές:
- “Πώς το Herceptin επιδρά στα καρκινικά κύτταρα του μαστού" από την ιστοσελίδα beyondthedish.wordpress.com με άδεια Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License.
Βλέπε: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/ - Travis, C. R., Key, T. J. 2003. Έκθεση σε οιστρογόνα και κίνδυνος εκδήλωσης καρκίνου του μαστού. Βλέπε: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC314432/
- Verma, M. 2012. Εξατομικευμένη Ιατρική και Καρκίνος. Βλέπε: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4251363/
Υποσημειώσεις
1 Καρκίνος του Μαστού Κατάσταση HER2. www.cancer.org
2 EUPATI Open Classroom. Βιοδείκτες.
3 EUPATI Open Classroom. Μοριακός βιοδείκτης.