Last update: 17 июня 2015
Новые исследовательские направления стимулируют развитие персонализированной медицины.
Молекулярная генетика
Благодаря осуществляемым на сегодняшний день исследованиям получено множество данных о болезнях на клеточном и молекулярном уровнях. Имеются доказательства тому, что отдельные изменения (вариации) в генах могут воздействовать на то, как функционируют клетки и как может развиваться болезнь. Заболевания с похожей симптоматикой могут диагностироваться как одно и то же заболевание. Тем не менее, они могут быть вызваны различными генетическими вариациями.
Эпигенетика
Эта растущая область помогает специалистам распознать, каким образом изменения соотносятся с заболеванием. Эпигенетика — дисциплина, изучающая возможности включения и выключения генов, регуляции экспрессии генов (и их положения) без затрагивания последовательности ДНК. От эпигенетических изменений может зависеть реакция организма пациента на лечение, поскольку эти изменения могут производиться в ответ на факторы, связанные с окружающей средой и образом жизни, например, воздействием УФ-лучей, диетой, курением или стрессом. В перспективе возможен учет индивидуальных эпигенетических особенностей в рамках персонализированной медицины.
Разработка биомаркеров и медицинских препаратов
Процессы, происходящие на клеточном и молекулярном уровнях, можно измерять с помощью «биомаркеров». Примерами биомаркеров являются
- результаты физиологических обследований, например, измерение уровня кровяного давления или температуры тела;
- биологические вещества («биохимия»), например, измерение уровня энзимов или гормонов;
- изменения в генах;
- снимки магнитно-резонансной томографии (МРТ).
Биомаркеры все чаще используются при разработке медицинских препаратов для обеспечения адресного лечения. Благодаря этому возможно
- повышение результативности лечения для пациентов, поскольку врач может подобрать медицинские препараты, необходимые данному конкретному пациенту, при этом уменьшается риск серьезных побочных эффектов;
- повышение эффективности разработки медицинских препаратов, поскольку доклинические и клинические испытания проводятся более эффективно, требуют меньше времени и становятся безопаснее.
Фармакогенетика или фармакогеномика
Одним из все чаще используемых биомаркеров являются индивидуальные генетические или геномные данные. Изучением воздействия генетики и геномики на индивидуальную реакцию на лечение занимаются фармакогенетика и фармакогеномика. Эти дисциплины помогают предусмотреть лечение в зависимости от индивидуальной конфигурации генов. Ряд медицинских препаратов, представленных сегодня на рынке, можно назначать только после проведения генетического анализа, обеспечивая конкретному пациенту безопасность курса лечения. Например:
- пациенты с вирусом иммунодефицита направляются на анализ генетического изменения, известного как HLA B*5701, до назначения им медицинского препарата абакавира, так как известно, что с этим генетическим изменением связана отрицательная реакция на препарат.
Кроме того, ряд других медицинских препаратов, представленных на рынке, сопровождается рекомендациями врачам по использованию геномных данных отдельного пациента при назначении этих препаратов. Геномные данные могут помочь врачу выяснить, является ли определенный препарат оптимальным средством для пациента, а также определить оптимальную дозу. Например:
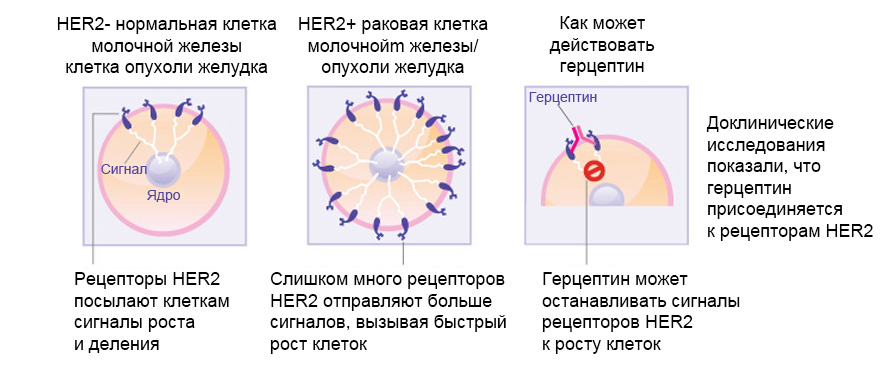
Трастузумаб (герцептин) — это препарат из класса моноклональных антител, действующий на уровне онкогена против рецепторов эпидермального фактора роста человека 2-го типа (HER-2), одобренный для лечения рака молочной железы на ранних стадиях. В приблизительно 20% случаев рака молочной железы количество HER-2 превышает норму, подавая вызывая избыточные сигналы внутрь клетки, что в свою очередь вызывает стимулирует все более быстрый рост клеток опухоли молочной железы. Лечение трастузумабом приносит положительный эффект только пациенткам с высоким уровнем содержания рецепторов HER-2. HER-2 имеется на поверхности некоторых клеток раковой опухоли, будучи встроен в клеточную мембрану. Действие трастузумаба выражается в его присоединении к рецепторам HER-2 на поверхности клеток опухоли молочной железы, в связи с чем эти клетки не получают сигналы к росту. Блокируя сигналы к росту, трастузумаб может замедлить или остановить рост опухоли молочной железы, а также является примером терапии, направленной на иммунитет.
Биобанки
Исследования, в которых используются данные биобанков, особенно важны для развития персонализированной медицины, при этом биобанки также все чаще применяются в клинических исследованиях новых лекарственных препаратов. Биобанки — это масштабные организованные наборы донорских образцов крови и (или) тканей, полученные от пациентов и здоровых волонтеров. В биобанках также фиксируется тщательно отобранная информация о состоянии здоровья донора, его образе жизни (питание, курение и т.п.) и других факторах. Биобанки предоставляют возможность изучить огромные количества образцов клеток и молекул, при этом эта информация тесно связана с клиническими и прочими данными. Скомбинированная таким образом информация помогает нам понять,
- почему у разных людей развиваются разные заболевания,
- почему у разных людей степени тяжести заболевания отличаются,
- и почему огранизм у разных пациентов по-разному реагирует на лечение.
Чем больше образцов появляется в биобанках, тем большую эффективность могут принести такие исследования. Многие страны формируют собственные биобанки. EuroBioBank является примером объединения биобанков разных стран, предоставляющим еще большие возможности исследований (в данном случае, редких заболеваний).
Справочная литература
- How Herceptin affects breast cancer cells” by beyondthedish.wordpress.com is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License.
See: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/
A2-1.08.2-V1.6