Last update: 8 июля 2015
Биодоступность
Биодоступность определяется как доля (в процентном выражении) вводимой дозы медицинского препарата, который попадает в кровоток (систему кровообращения) в неизмененном виде.
При использовании любого медицинского препарата основной задачей является попадание в организм активного вещества, содержащегося в этом препарате, которое также именуется «активным фармацевтическим ингредиентом» (АФИ). Однако для оказания терапевтического эффекта активному веществу недостаточно просто попасть в организм. Нужно, чтобы правильная доза активного вещества оказалась в конкретном месте в организме и там оказала свое действие. Это конкретное место в организме называется «мишенью». Кроме того, правильная доза активного вещества должна достичь мишени за определенный промежуток времени и оставаться там в течение определенного времени.
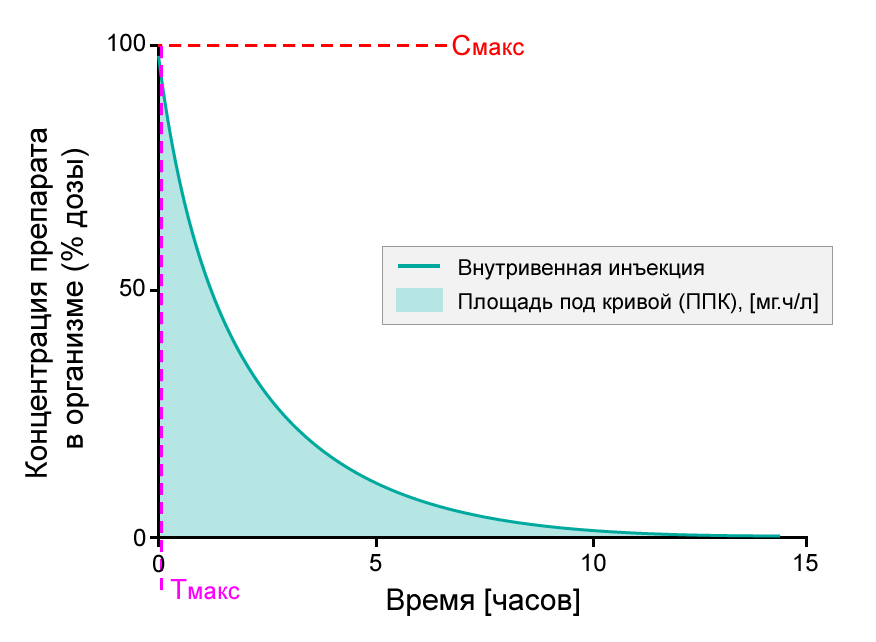
При введении инъекции непосредственно в кровоток, например, внутривенной инъекции (ВИ), биодоступность определяется как 100%-ная (см. рисунок ниже).
- Исследование процентного содержания активного вещества в организме, или биодоступности, после перорального приема таблетки в течение 15 часов. Площадь под кривой (ППК) затемнена. Tмакс — это момент, когда концентрация медицинского препарата в крови является самой высокой, а Cмакс отражает максимальную концентрацию медицинского препарата в крови.
При инъекционном введении активное вещества достигает мишени после сложного путешествия в кровяном потоке. При оценке биодоступности осуществляется сбор образцов крови для определения концентрации активного вещества в крови (системе кровообращения). Таким образом, биодоступность сразу после введения инъекции составит 100%, поскольку активное вещество введено непосредственно в кровь. Это можно наблюдать на оси y на вышеприведенном рисунке (внутривенная биодоступность). Так, если в кровоток введено 75 миллиграммов (мг) активного вещества, 100% представлены как 75 мг активного вещества.
Когда активное вещество циркулирует в организме через кровоток, часть его попадает в процессы обмена веществ или выводится, что, соответственно, со временем снижает концентрацию активного вещества в организме (см. рисунок выше). Активное вещество оценивается и сравнивается с другими медицинскими средствами по характеристикам биодоступности по площади под кривой (ППК), которая демонстрирует общее воздействие активного вещества на организм. Время, когда в крови наблюдается самая высокая концентрация активного вещества, обозначено как Тмакс,, а максимальная концентрация активного вещества обозначена Cмакс.
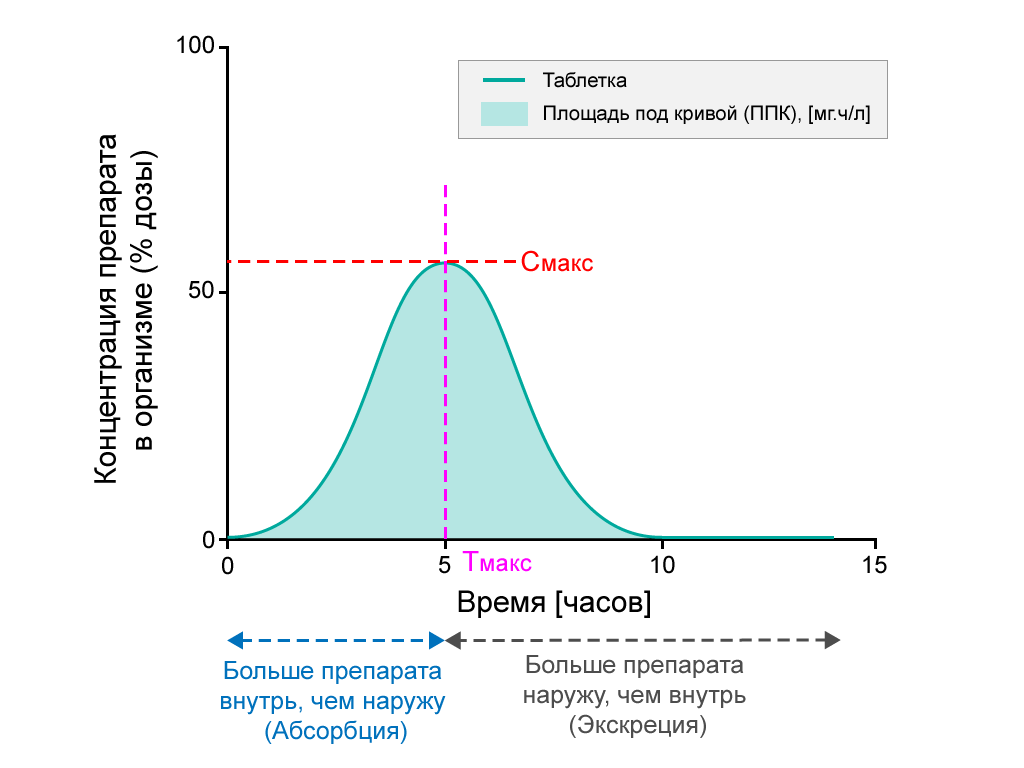
При введении аналогичного количества активного вещества другим способом, например, перорально (в виде таблетки через рот), биодоступность составит меньше 100% (см. рисунок «Биодоступность при пероральном введении») ниже.
- Исследование процентного содержания активного вещества после перорального приема таблетки в течение 15 часов. ППК затемнена. Tмакс — это момент, когда концентрация медицинского препарата в кровотоке является самой высокой, а Cмакс отражает максимальную концентрацию медицинского препарата в крови.
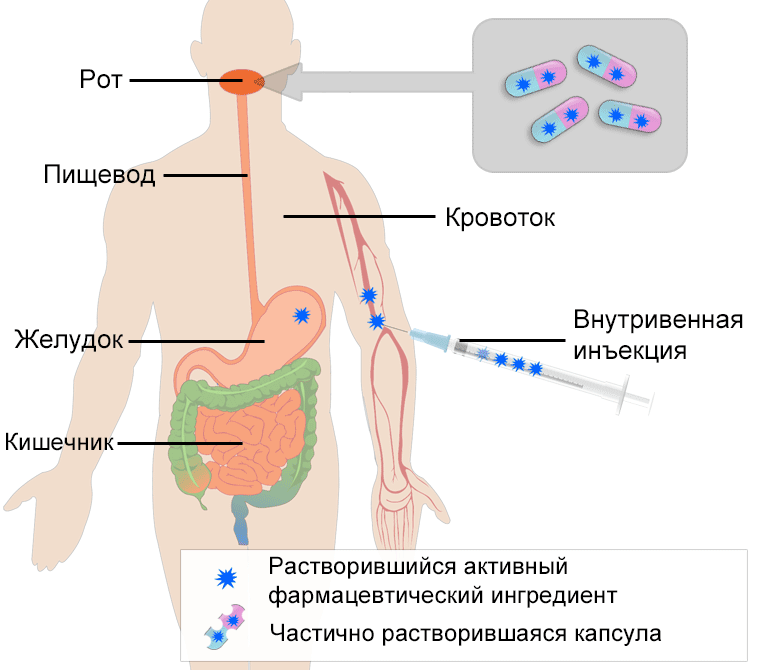
- Схематическое изображение усвоения принятой перорально капсулы и инъекции, введенной непосредственно в кровоток (внутривенной инъекции). После попадания в желудок капсула переносится в тонкий кишечник, где происходит дальнейшее всасывание.
Биодоступность при пероральном введении
Исследование процентного содержания активного вещества после перорального приема таблетки в течение 15 часов. ППК заштрихована. Tмакс — это момент, когда концентрация медицинского препарата в кровотоке является самой высокой, а Cмакс отражает максимальную концентрацию медицинского препарата в крови.
Уменьшение биодоступности при пероральном введении по сравнению с внутривенным введением рассматривается на нижеприведенном рисунке («Биодоступность при пероральном введении против биодоступности при внутривенном введении»):
После проглатывания таблетки или капсулы последние попадают в желудок в течение одной-двух минут.1 В желудке таблетка или капсула растворяются, и часть активного вещества всасывается в кровь. Компоненты переносятся в тонкий кишечник, где завершается процесс всасывания. Всасывание из желудочно-кишечного тракта может происходить по-разному. Более низкий уровень биодоступности может объясняться незначительным всасыванием из желудка или кишечника или его отсутствием, поэтому этот этап имеет важное значение для доступности.
Когда активное вещество всасывается в кровь, оно сначала попадает в воротную вену (печени) и затем переносится в печень. Происходит первый этап включения активного вещества в обмен веществ в печени, который носит название «пресистемный метаболизм. На этом первом этапе включения активного вещества в обмен веществ расщепление некоторых активных веществ происходит в большей степени, других — в меньшей. Нерасщепленная часть активного вещества, как правило, составляющая менее 100%, попадает в кровообращение через вену печени. То количество, которое в итоге попадает в систему кровообращения, рассматривается как «абсолютная биодоступность».
Абсолютная биодоступность сравнивает биодоступность АФИ в системе кровообращения после введения не внутривенным способом с биодоступностью того же медицинского препарата при введении его внутривенно. Это процентная доля АФИ, абсорбированного в результате не внутривенного введения, в сравнении с соответствующим медицинским препаратом, введенного внутривенно.
Говоря кратко, в случае с абсолютной биодоступностью внутривенное введение всегда является стандартом.
Относительная биодоступность характеризует биодоступность лекарственной формы (А) определенного медицинского препарата при сравнении с другой лекарственной формой (В) того же лекарственного препарата и обычно является установленным стандартом для случаев не внутривенного введения, когда введение осуществляется по другому каналу.
На биодоступность влияет ряд других факторов, которые могут обнаруживаться в качестве индивидуальных особенностей у любого человека. См. примеры биодоступности в прилагаемом информационном бюллетене.
Биоэквивалентность
Биоэквивалентность отражает отношения между двумя рецептурами одного и того же лекарственного препарата с аналогичной биодоступностью, вводимых в аналогичной дозировке.
Относительная биодоступность используется при сравнении не только разных лекарственных форм, но в случаях, когда необходимо сравнить две таблетки (или другие медицинские препараты в аналогичной лекарственной форме), содержащие одно и то же активное вещество, от разных производителей. Таблетка компании А — это препарат-дженерик, который сравнивается с эталонным препаратом компании В (брендовым препаратом). Для того чтобы выяснить, является ли таблетка А биоэквивалентной таблетке В, сравниваются показатели биодоступности этих двух медицинских препаратов.2
Дополнительные источники
- Управление по контролю пищевых продуктов и лекарственных средств США (2002). Guidance for industry: Bioavailability and bioequivalence studies for orally administered drug products – General considerations. Rockville, MD: Food and Drug Administration. Источник по состоянию на 23 июня 2015 г.: http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM154838.pdf
- Wang, H., Li, Q., Reyes, S., Zhang, J., Xie, L., Melendez, V., Hickman, M. and Kozar, M.P. (2013). Formulation and particle size reduction improve bioavailability of poorly water-soluble compounds with antimalarial activity. Malaria Research and Treatment, Источник по состоянию на 23 июня 2015 г.: http://dx.doi.org/10.1155/2013/769234
- Johnson, J.A. (2000). Predictability of the effects of race or ethnicity on pharmacokinetics of drugs. International Journal of Clinical Pharmacology and Therapeutics, 38, 53-60.
Справочная литература
- Tatum, R.P., Shi, G., Manka, M.A., Brasseur, J.G., Joehl, R.J. and Kahrilas, P.J. (2000). Bolus transit assessed by an esophageal stress test in postfundoplication dysphagia. Journal of Surgical Research, 91, 56–60.
- MobiSystems, Inc. (2007). Dorland's Medical Dictionary for Health Consumers. [Mobile application software].
Приложения
- Информационный бюллетень Примеры биодоступности
Size: 101,131 bytes, Format: .docx
Примеры биодоступности, связанные с пенициллином и астмой.
A2-1.16-V1.2