Last update: 18 lipca 2023
Nadrzędne zasady dotyczące zaangażowania pacjentów w cały proces badania i rozwoju leków
Europejska Akademia Pacjentów (EUPATI) to ogólnoeuropejski projekt Inicjatywy w zakresie Leków Innowacyjnych (IMI) skupiający 33 podmioty współpracujące z organizacjami pacjentów, uniwersytetami, organizacjami non-profit i firmami farmaceutycznymi. We wszystkich materiałach EUPATI termin „pacjent” odnosi się do wszystkich grup wiekowych i pełnego spektrum chorób. EUPATI nie skupia się na problemach lub terapiach typowych dla określonych chorób, ale na ogólnym procesie rozwoju leków. Informacje o konkretnych wskazaniach oraz interwencjach dla konkretnej grupy wiekowej lub z wykorzystaniem konkretnych leków wykraczają poza zakres kompetencji EUPATI i pozostają w gestii lekarzy oraz organizacji pacjentów. Więcej informacji można znaleźć na eupati.eu/.
Zdecydowana większość ekspertów zaangażowanych w rozwój i ocenę leków to naukowcy pracujący zarówno w sektorze prywatnym, jak i publicznym. Istnieje coraz większa potrzeba wykorzystania wiedzy i doświadczeń pacjentów, aby zrozumieć, jak wygląda życie osoby z określoną chorobą, jak sprawowana jest opieka oraz z czym wiąże się codzienne stosowanie leków. Ta wiedza pomaga udoskonalać proces odkrywania, rozwoju i oceny nowych, skutecznych leków.
Konieczne są usystematyzowane interakcje między pacjentami we wszystkich grupach wiekowych reprezentującymi pełne spektrum chorób, ich przedstawicielami i innymi zainteresowanymi stronami. Takie interakcje umożliwiają wymianę informacji i konstruktywny dialog na szczeblu krajowym i europejskim, w ramach którego mogą i powinny być rozpatrywane opinie użytkowników leków. Trzeba przy tym pamiętać o możliwym zróżnicowaniu systemów opieki zdrowotnej, praktyk i przepisów prawa.
Zalecamy ścisłą współpracę i partnerstwo między różnymi stronami zainteresowanymi, w tym z organizacjami pracowników opieki zdrowotnej, firmami prowadzącymi badania na zlecenie, organizacjami pacjentów i konsumentów*, środowiskiem akademickim, towarzystwami naukowymi i akademickimi, organami regulacyjnymi i organami oceny technologii medycznych oraz branżą farmaceutyczną. Dotychczasowe doświadczenie pokazuje, że efektem zaangażowania pacjentów była większa przejrzystość, zaufanie i wzajemny szacunek między nimi a innymi stronami zainteresowanymi.
Uznaje się, że wkład pacjentów w odkrywanie, rozwój i ocenę leków wzbogaca jakość dostępnych dowodów i opinii [1].
Istniejące kodeksy postępowania dotyczące zaangażowania pacjentów w działania różnych stron zainteresowanych nie ujmują wyczerpująco pełnego zakresu zagadnień związanych z badaniami i rozwojem.& Wytyczne EUPATI służą wspieraniu integracji zaangażowania pacjentów w cały proces badania i rozwoju leków.
Niniejsze wytyczne z założenia nie mają charakteru normatywnego i nie dostarczają szczegółowych porad.
W EUPATI opracowano te wytyczne dla wszystkich stron zainteresowanych, które zamierzają wchodzić w interakcje z pacjentami w związku z badaniem i rozwojem leków.& Użytkownicy mogą odstępować od niniejszych wytycznych w zależności od konkretnych okoliczności, ustawodawstwa krajowego lub szczególnych potrzeb każdej interakcji. Niniejsze wytyczne należy dostosować do indywidualnych wymogów, kierując się najlepszą profesjonalną oceną.
Opracowano cztery osobne zbiory wytycznych obejmujące zaangażowanie pacjentów w:
- badanie i rozwój leków prowadzone przez branżę farmaceutyczną&,
- komisje bioetyki,
- organy nadzorujące,
- ocenę technologii medycznych.
Wszystkie wytyczne wskazują obszary, w których obecnie istnieją możliwości angażowania pacjentów. Niniejsze wytyczne powinny być poddawane okresowym przeglądom i korektom w celu odzwierciedlenia zachodzących zmian.
Niniejsze wytyczne obejmują swoim zakresem zaangażowanie pacjentów w obszarze regulacyjnym i czerpią z zaawansowanego dokumentu „Framework for interaction between the European Medicines Agency and patients and consumers and their organisations”.
Niniejsze wytyczne opierają się na niżej wymienionych wartościach, które można wprowadzić w życie poprzez przyjęcie sugerowanych metod działania (punkt 7). Są to:
| Odpowiedniość | Pacjenci dysponują szczególną wiedzą, perspektywami i doświadczeniami, które znacznie wzbogacają zasadnicze aspekty działań regulacyjnych |
| Uczciwość | Pacjenci mają takie samo prawo do udziału w działaniach regulacyjnych jak inne strony zainteresowane oraz do dostępu do wiedzy i doświadczeń, które umożliwiają skuteczne zaangażowanie |
| Sprawiedliwość | Zaangażowanie pacjentów w działania regulacyjne przyczynia się do większej sprawiedliwości, jako że stanowi próbę zrozumienia zróżnicowanych potrzeb pacjentów z określonymi problemami zdrowotnymi w kontekście rygorystycznych wymogów określonych w przepisach prawa i w wytycznych |
| Zasadność | Angażowanie pacjentów ułatwia udział w działaniach regulacyjnych osobom, których dotyczą decyzje regulacyjne, przyczyniając się do zwiększenia przejrzystości, odpowiedzialności i wiarygodności w procesie podejmowania decyzji |
| Budowanie potencjału | Procesy angażowania pacjentów pozwalają pokonywać przeszkody w angażowaniu pacjentów w działania regulacyjne i zwiększają możliwości współpracy między pacjentami i organami regulacyjnymi |
Wszystkie wytyczne opracowywane w późniejszym terminie należy dostosować do istniejącego ustawodawstwa krajowego dotyczącego interakcji określonych w czterech wydanych przez EUPATI dokumentach zawierających wytyczne.
Wyłączenie odpowiedzialności
W EUPATI opracowano te wytyczne dla wszystkich stron zainteresowanych, które zamierzają wchodzić w interakcje z pacjentami w związku z badaniem i rozwojem leków przez cały cykl badania i rozwoju leków.&&
Niniejsze wytyczne z założenia nie mają charakteru normatywnego i nie dostarczają szczegółowych porad. Niniejsze wytyczne należy stosować w zależności od konkretnych okoliczności, ustawodawstwa krajowego lub szczególnych potrzeb każdej interakcji. Niniejsze wytyczne należy dostosować do indywidualnych wymogów, kierując się najlepszą profesjonalną oceną.
Jeśli w niniejszych wytycznych zawarto porady dotyczące kwestii prawnych, nie należy taktować ich jako ostatecznej interpretacji prawnej i nie zastępują one formalnych porad prawnych. Jeśli potrzebne są porady formalne, strony zainteresowane powinny skonsultować się ze swoimi działami prawnymi, jeśli takie posiadają, lub zwrócić się o poradę prawną do kompetentnych źródeł.
EUPATI w żadnym wypadku nie odpowiada za jakiekolwiek skutki wykorzystania niniejszych wytycznych.
Projekt EUPATI uzyskał wsparcie ze Wspólnego Przedsięwzięcia na rzecz Inicjatywy w zakresie Leków Innowacyjnych na mocy umowy dotacji nr 115334, której środki pochodzą z siódmego programu ramowego Unii Europejskiej (FP7/2007-2013), a także od firm członkowskich zrzeszonych w Europejskiej Federacji Przemysłu i Stowarzyszeń Farmaceutycznych.
Zakres
Niniejsze wytyczne europejskie obejmują swoim zakresem interakcje między pacjentami a organami regulacyjnymi do spraw leków dotyczące leków stosowanych u ludzi. Termin „pacjenci” może oznaczać indywidualnych pacjentów lub ich opiekunów lub przedstawicieli organizacji pacjentów dysponujących odpowiednią wiedzą specjalistyczną (punkt 4). Organy regulacyjne obejmują zarówno właściwe organy krajowe (krajowe organy regulacyjne), jak i Europejską Agencję Leków (EMA). Organizacje pacjentów to organizacje non-profit zainteresowane opieką nad pacjentami, w których pacjenci stanowią większość członków w organach kierowniczych.
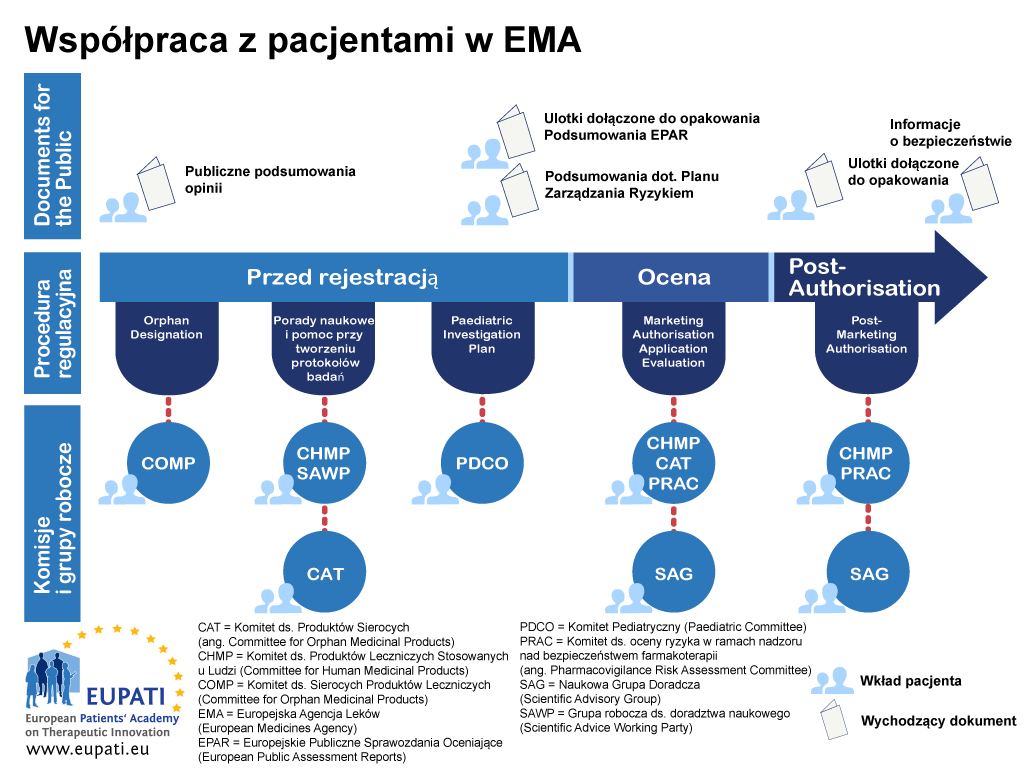
Wytyczne koncentrują się na zaangażowaniu i nie obejmują swoim zakresem naukowego opracowania zagadnień z perspektywy pacjenta (tj. ilościowego i jakościowego systematycznego badania psychospołecznego wpływu chorób i terapii). Rycina 1 wskazuje etapy, na jakich pacjenci mogą być obecnie angażowani w cykl badań i rozwoju leków, jednak nie ma to ograniczać potencjalnego zaangażowania, a z czasem możliwości mogą się zmieniać i rozszerzać.&
Definicja terminu „pacjent”
Termin „pacjent” jest często stosowany ogólnie i nieprecyzyjnie, przez co nie odzwierciedla różnych typów informacji i doświadczeń wymaganych od pacjentów, rzeczników pacjentów i organizacji pacjentów w różnych procesach współpracy.
Aby doprecyzować terminologię na potrzeby opisu potencjalnych ról, jakie mogą odgrywać interakcje z pacjentami przedstawione w tych i innych wytycznych EUPATI, zastosowano tu termin „pacjent” obejmujący następujące definicje:
- „Indywidualni pacjenci” to osoby dysponujące osobistym doświadczeniem życia z chorobą. Mogą mieć techniczną wiedzę dotyczącą badania i rozwoju lub procesów regulacyjnych, choć nie jest to konieczne, ponieważ ich główną rolą jest przekazywanie swoich subiektywnych doświadczeń związanych z chorobą i terapią.&
- „Opiekunowie” to osoby wspierające indywidualnych pacjentów, takie jak członkowie rodziny oraz opłacani pomocnicy czy wolontariusze.
- „Rzecznicy pacjentów” to osoby, które dysponują wiedzą i doświadczeniem z zakresu wspierania większej populacji pacjentów dotkniętych konkretną chorobą. Mogą być stowarzyszeni z jakąś organizacją, ale nie jest to konieczne.
- „Przedstawiciele organizacji pacjentów” to osoby upoważnione do reprezentowania i wyrażania wspólnych opinii organizacji pacjentów na temat konkretnego problemu lub choroby.
- „Pacjenci eksperci” mają wiedzę specjalistyczną z zakresu konkretnej choroby, a ponadto techniczną wiedzę o badaniu i rozwoju leków i/lub zagadnieniach regulacyjnych uzyskaną poprzez szkolenia lub doświadczenie; są to np. członkowie EUPATI, którzy zostali przeszkoleni przez EUPATI w pełnym spektrum zagadnień dotyczących badania i rozwoju leków.&&
Mogą pojawić się zastrzeżenia dotyczące angażowania indywidualnych pacjentów we wspólne działania ze stronami zainteresowanymi, oparte na twierdzeniu, że uzyskane od nich informacje będą subiektywne i podatne na krytykę. Jednak EUPATI wraz z innymi organami regulacyjnymi stara się krzewić wartość sprawiedliwości poprzez niewykluczanie zaangażowania indywidualnych osób. Wybór najodpowiedniejszej reprezentacji pacjentów pod względem dopasowania typu pacjentów do określonego działania powinien należeć do organizacji inicjującej interakcję (zob. punkt 7). W przypadku angażowania indywidualnych pacjentów sugeruje się, aby poinformować odpowiednią organizację pacjentów i/lub skonsultować się z nią w celu uzyskania wsparcia i/lub porady, jeśli taka organizacja funkcjonuje w danym miejscu.
Przed zaangażowaniem takiej osoby należy wspólnie uzgodnić rodzaj dostarczanych informacji i upoważnienie zaangażowanej osoby.
Uzasadnienie wytycznych
Zakres zaangażowania pacjentów w kwestie regulacyjne znacznie różni się w zależności od państwa i regionu Europy.
EMA współdziała ze stronami zainteresowanymi od początku swojego istnienia, tj. od 1995 r. Relacje ze stronami zainteresowanymi ewoluowały, a typ i stopień interakcji jest różny w zależności od określonej grupy zainteresowanych stron i typu działania EMA. Składy zarządu EMA i niektórych komitetów naukowych obejmują pacjentów i konsumentów.
Korzyści angażowania stron zainteresowanych dostrzeżone przez EMA zainspirowały kilka krajowych organów regulacyjnych do wdrożenia ram umożliwiających angażowanie pacjentów również na poziomie krajowym. Większość krajowych organów regulacyjnych czerpie z doświadczeń EMA. Zaangażowanie pacjentów w działalność EMA jest określone w prawie europejskim [2]. Agencja EMA, jej zarząd i różne komitety naukowe są odpowiedzialne za rozwijanie relacji między agencją EMA a jej stronami zainteresowanymi.
W prawie europejskim zdefiniowano:
- bezpośrednie interakcje między EMA a organizacjami pacjentów i konsumentów za pośrednictwem Grupy Roboczej Pacjentów i Konsumentów (PCWP);
- ramy umożliwiające dostarczanie tym organizacjom jasnych i użytecznych informacji;
- specjalne formy interakcji, np. członkostwo pacjentów w zarządzie EMA, Komitecie ds. Sierocych Produktów Leczniczych (COMP), Komitecie Pediatrycznym (PDCO), Komitecie ds. Terapii Zaawansowanych (CAT), udział w procedurach dotyczących uzyskiwania opinii naukowych / pomocy w kwestiach regulacyjnych wraz z Grupą Roboczą ds. Doradztwa Naukowego (SAWP) oraz Komitetem ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii (PRAC);
- ponadto agencja EMA wdrożyła metody gromadzenia informacji od pacjentów przez bezpośrednie konsultacje.
Dotychczasowe doświadczenie pokazuje, że efektem udziału pacjentów w działaniach EMA była większa przejrzystość i zaufanie do procesów regulacyjnych oraz wzajemny szacunek między organami regulacyjnymi a społecznością pacjentów i konsumentów. Doświadczenie potwierdza wagę wsparcia przez agencję EMA udziału pacjentów w jej pracach oraz ułatwiania tego udziału przez agencję.
Na szczeblu krajowym może nie być podobnych przepisów prawnych. W przypadku braku przepisów prawnych właściwe organy krajowe opracowują własne ramy na bazie doświadczeń EMA lub samodzielnie. Kluczowe elementy, które należy wziąć pod uwagę przy opracowywaniu takich ram, obejmują:
- zdefiniowanie roli pacjentów w interakcji,
- włączenie propozycji dotyczących angażowania pacjentów w konkretne procesy instytucjonalne,
- opracowanie programu szkoleniowego,
- przygotowanie koncepcji wynagrodzeń dla ekspertów obejmującej wszystkie strony zainteresowane,
- stała ocena interakcji pod kątem możliwości jej udoskonalania oraz współpraca agencji z pacjentami w celu ustanowienia i ustandaryzowania metod i praktyk.
Wszystkie ramy należy regularnie poddawać przeglądom.
Cele angażowania pacjentów w prace nad regulacjami dotyczącymi leków
Dwie podstawowe zasady, które należy wziąć pod uwagę podczas wdrażania ram, to usprawnienie interakcji z pacjentami i koncentracja na obszarach, w których można spodziewać się obopólnych korzyści.
Celem powinno być dalsze budowanie przejrzystości i zaufania w relacjach ze społecznościami pacjentów poprzez ich aktywne angażowanie (udział-konsultacja-informacja). Aby osiągnąć ten cel, należy realizować konkretne cele, takie jak:
- wspieranie organu regulacyjnego w uzyskiwaniu dostępu do rzeczywistych doświadczeń związanych z chorobami i ich leczeniem i zdobywaniu informacji o aktualnym stosowaniu leków; przyczyni się to do zrozumienia postrzeganej przez pacjentów wartości dowodów naukowych dostarczanych w toku procesu oceny na potrzeby podejmowania decyzji o stosunku korzyści do ryzyka;
- zapewnianie, że pacjenci i ich organizacje przedstawicielskie zostaną wysłuchani, że będą prowadzone z nimi konsultacje oraz że zostaną zaangażowani w opracowywanie polityki i planów;
- zwiększanie zrozumienia przez organizacje pacjentów mandatu i roli organu regulacyjnego w kontekście rozwoju, oceny, zatwierdzania, monitorowania i dostarczania informacji o lekach;
- optymalizacja narzędzi komunikacyjnych (w zakresie treści i ich dostarczania) w celu ułatwiania i pobudzania kaskady informacji docierających do kręgów reprezentowanych przez organizacje pacjentów (tj. aby dotrzeć do indywidualnych pacjentów) dla wspierania ich roli w bezpiecznym i racjonalnym stosowaniu leków;
- ułatwianie udziału pacjentów w ocenie korzyści/ryzyka i w powiązanych działaniach, aby poznać wartości i preferencje pacjentów oraz uzyskać informacje o aktualnym stosowaniu leków i o ich środowisku terapeutycznym przez cały cykl rozwoju leków od wczesnego etapu rozwoju, poprzez ocenę, aż po badania porejestracyjne.
Osiągnięcie tych celów wymaga ścisłej współpracy między organami regulacyjnymi, krajowymi ministerstwami zdrowia i innymi właściwymi stronami zainteresowanymi, jak również aktywnego udziału pacjentów, pracowników ochrony zdrowia i ich organizacji przedstawicielskich oraz dobrych interakcji z nimi.
Sugerowane metody działania (na podstawie ram interakcji EMA)
Na podstawie doświadczeń EMA na poziomie europejskim pacjenci mogą uczestniczyć w działaniach organów regulacyjnych w następujących rolach:
- członkowie (i zastępcy) niektórych grup roboczych lub komitetów (naukowych) organu regulacyjnego oraz w przypadku EMA — członkowie zarządu EMA (formalnie mianowani przez instytucje UE);
- indywidualni eksperci;
- przedstawicie konkretnych organizacji, z którymi prowadzone są konsultacje i którzy uczestniczą w dyskusjach w celu wyrażenia opinii organizacji na temat określonych problemów;
- czasami jako obserwatorzy w niektórych aspektach prac EMA lub organu regulacyjnego.
Organy regulacyjne powinny określić kryteria kwalifikacji.
Kiedy pacjenci uczestniczą w działaniach organu regulacyjnego jako indywidualne osoby, a nie jako przedstawiciele swoich organizacji, powinni zadeklarować wszelkie interesy i przestrzegać kodeksu postępowania organu regulacyjnego tak samo jak inny eksperci. Ponadto organizacje zaangażowane w prace organu regulacyjnego powinny zachować pełną przejrzystość w zakresie swoich działań i źródeł finansowania.
Aby osiągnąć cele wskazane w punkcie 4, należy wziąć pod uwagę sześć poniższych elementów o krytycznym znaczeniu:
- Sieć organizacji pacjentów (potencjalnie we współpracy z innymi organami regulacyjnymi)Sieć organizacji pacjentów pozwala organowi regulacyjnemu na budowane spójnych i ukierunkowanych interakcji z szeroką grupą organizacji posiadających zróżnicowany zakres wiedzy specjalistycznej i interesów. Należy zastosować kryteria doboru. Takie kryteria powinny zapewnić, aby organ regulacyjny nawiązywał kontakt z najodpowiedniejszymi organizacjami reprezentującymi pacjentów w przejrzysty sposób. Kryteria te powinny być ujednolicone w obrębie sieci.
- Forum wymiany informacji z organizacjami pacjentów ustanowione w obrębie organu regulacyjnegoJest to platforma dialogu i wymiany informacji z organizacjami pacjentów na temat istotnych problemów dotyczących leków stosowanych u ludzi i, kiedy ma to zastosowanie, wyrobów medycznych; poprzez tę platformę organ regulacyjny informuje i uzyskuje informacje zwrotne oraz opinie od pacjentów w ramach różnych inicjatyw organu regulacyjnego. Obejmuje to zrównoważoną reprezentację różnych typów pacjentów i organizacji reprezentujących specjalne i wrażliwe populacje słabo reprezentowane w toku rozwoju leków, takie jak osoby starsze i kobiety. Powinno być to forum umożliwiające wskazywanie luk i priorytetów w ogólnych interakcjach.
- Pula indywidualnych pacjentów działających jako eksperci z zakresu swojej choroby i jej leczenia, która ułatwi angażowanie pacjentów w ocenę leków i informowanie o lekachUtworzenie puli ekspertów umożliwi organowi regulacyjnemu szybkie i skuteczne określenie, którzy pacjenci mogą być zaangażowani w działania związane z produktem, w przegląd informacji o produkcie i materiałów komunikacyjnych.
- Interakcja szczególnie w obszarze komunikacji Będzie cennym wsparciem istniejących struktur zajmujących się publicznym rozpowszechnianiem informacji. Ponadto współpraca w tym obszarze będzie sprzyjać dostarczaniu pacjentom potwierdzonych i aktualnych informacji na temat korzyści i zagrożeń związanych z lekami oraz będzie przyczyniać się do opracowywania i rozpowszechniania zrozumiałych komunikatów na temat bezpiecznego i racjonalnego stosowania leków przeznaczonych dla społeczeństwa. Wszelkie materiały informacyjne dla pacjentów powinny być analizowane przez przedstawicieli pacjentów, aby polepszyć ich czytelność oraz odpowiedniość języka i treści.
- Program działań mający na celu budowanie potencjału, skupienie na szkoleniach i podnoszeniu wiedzy o systemie regulacyjnym Aby wkład pacjentów był konstruktywny, muszą oni rozumieć mandat organu regulacyjnego oraz oczekiwaną rolę pacjentów w procesie oceny. Powinien być dostępny program szkoleniowy. W niektórych organizacjach pacjentów lub innych wspólnych projektach opracowano własne materiały szkoleniowe, dzięki którym pacjenci zyskują narzędzia pozwalające im odgrywać rolę uznanych rzeczników.
- Wsparcie finansowe Należy zapewnić wsparcie finansowe pacjentom wnoszącym swój wkład w działania organu regulacyjnego. Jest ono wyrazem uznania za pracę wykonywaną przez te osoby i przyczynia się do ich niezależności. Pacjenci powinni być uznawani za ekspertów i traktowani według tych samych standardów co inni eksperci, również w odniesieniu do wynagrodzenia. Niekiedy pacjenci mogą potrzebować dodatkowej pomocy, dzięki której będą w stanie angażować się w określone działania.
Definiowanie interakcji
Przed każdą interakcją należy wspólnie uzgodnić następujące kwestie (gdzie ma to zastosowanie):
- cel działania angażującego pacjentów i/lub obszary wspólnego zainteresowania, aby ustanowić uzgodnioną i usystematyzowaną interakcję przy zapewnieniu wszystkim stronom koniecznej ochrony ich niezależności, prywatności, poufności i oczekiwań;
- rodzaj dostarczanych informacji i upoważnienie zaangażowanej osoby;
- narzędzia i metody interakcji np. częstość spotkań, podstawowe zasady, rozstrzyganie konfliktów, wynagrodzenie, ocena;
- należy omówić i wspólnie uzgodnić metodę interakcji (spotkania, telekonferencje itp.), starając się przede wszystkim zapewnić warunki dogodne dla pacjentów / organizacji pacjentów; jeśli interakcja wymaga spotkań osobistych lub opracowania czy zorganizowania wydarzeń, powinny one być zgodne z wymogami istniejących kodeksów postępowania co do odpowiedniego miejsca i warunków przyjęcia;
- kiedy organizowane są wydarzenia, należy wziąć pod uwagę zdolność uczestnictwa zakładanej grupy pacjentów i podjąć odpowiednie kroki, aby zapewnić dostępność, pomoc w transporcie i wstęp na wydarzenie;
- pożądana organizacja pacjentów lub partnerska organizacja pacjentów, z którą można nawiązać długoterminowe relacje przy zapewnieniu niezależności;
- profil typu pacjentów lub przedstawicieli pacjentów, którzy mają być zaangażowani, oraz ich liczba;
- jak będą wykorzystywane rezultaty podejmowanych działań;
- jak i kiedy zaangażowani pacjenci będą informowani o rezultatach;
- warunki umowy, w tym zgoda i zasady zachowania poufności, jak również umowa dotycząca samej interakcji (rodzaj spotkań, częstotliwość, wynagrodzenie);
- inne elementy w zależności od konkretnego działania.
Wyszukiwanie pacjentów i interakcja
Istnieje wiele sposobów określania, którzy pacjenci powinni być zaangażowani w interakcję. Głównie odbywa się to poprzez:
- istniejące organizacje pacjentów;
- EUPATI lub podobny projekt;
- reklamowanie możliwości udziału pacjentów;
- otwarte wezwanie;
- istniejące relacje ze świadczeniodawcami, szpitalami i badaczami oraz innymi agencjami;
- dobrowolne wnioski wcześniej złożone przez strony zainteresowane;
- istniejące rady / grupy doradcze (np. Grupa Robocza Pacjentów i Konsumentów przy EMA, Think Tank przy EFPIA);
- agencje będące stronami trzecimi.
Kryteria kwalifikacji
Organizacje pacjentów
Aby zwiększyć przejrzystość zaangażowania pacjentów, agencje i organizacje pacjentów powinny ująć w swoich planach doroczne publiczne ujawnienie wspólnie prowadzonych działań. Nazwiska indywidualnych pacjentów można ujawniać w przypadku osób będących członkami zwykłej rady doradczej, ale w innych przypadkach nie wolno ujawniać nazwisk.
Organizacje pacjentów powinny z zaangażowaniem brać aktywny udział w interakcji z organem regulacyjnym.
Są to organizacje założone w państwie członkowskim Unii Europejskiej (UE) lub Europejskiego Obszaru Gospodarczego (EOG), które spełniają następujące kryteria:
| Zasadność | Organizacja posiada statut zarejestrowany w jednym z państw członkowskich UE/EOG. Jeśli jest to organizacja międzynarodowa niezarejestrowana w państwie członkowskim UE/EOG, należy dostarczyć dodatkowych informacji wykazujących, że jej działalność jest skupiona na UE. |
| Misja/cele | Organizacja lub indywidualny pacjent ekspert ma jasno określoną misję i cele i taka organizacja lub osoba powinna zgodzić się na opublikowanie ich na witrynie internetowej organu regulacyjnego. |
| Działania | W ramach swojej działalności organizacja w szczególny sposób interesuje się produktami leczniczymi (i w stosownych przypadkach wyrobami medycznymi), co powinno być udokumentowane (np. poprzez raport opublikowany na witrynie internetowej organizacji lub indywidualnej osoby). |
| Reprezentacja | Organizacja jest reprezentatywna dla pacjentów w całej UE/EOG lub na odpowiednim poziomie krajowym. Uznaje się, że organizacje zarejestrowane już na szczeblu wspólnotowym, np. w Forum Zdrowia UE czy w Radzie Europy, odpowiednio reprezentują pacjentów lub mogą być angażowane w działania regulacyjne dotyczące leków.
W przypadku braku europejskich organizacji zajmujących się konkretną chorobą lub obszarem terapeutycznym można rozważyć zaangażowanie krajowych organizacji, choć preferowane będą organizacje ogólnoeuropejskie. Można również wziąć pod uwagę organizacje międzynarodowe, jeśli koncentrują się na Europie i mają tu swoją reprezentację, w tym biura w UE/EOG. |
| Struktura | Organizacja powinna mieć organy kierownicze wybierane przez jej członków, którymi są pacjenci, ich opiekunowie lub ich wybrani przedstawiciele. |
| Odpowiedzialność i sposoby konsultacji | Oświadczenia i opinie organizacji powinny odzwierciedlać opinie jej członków i należy wdrożyć odpowiednie procedury konsultacji z tymi członkami. W szczególności organizacja powinna zapewnić odpowiedni przepływ informacji, aby umożliwić obustronny dialog: od członków i do członków. |
| Przejrzystość | Organizacja ujawnia organowi regulacyjnemu swoje publiczne i prywatne źródła finansowania, podając nazwę podmiotu i jego wkład finansowy, zarówno w wartościach bezwzględnych, jak i w postaci procentowego udziału w budżecie organizacji. Wszelkie powiązania ze sponsoringiem korporacyjnym powinny być jasne i przejrzyste. Informacje te są przekazywane do Agencji raz do roku.
W przypadku organizacji patronackich należy udostępnić agencji listę stowarzyszeń członkowskich. Organizacja publikuje na swojej witrynie internetowej zarejestrowany statut wraz z informacjami finansowymi obejmującymi publiczne i prywatne źródła finansowania oraz informacje o swojej działalności. Organizacja przestrzega zasad kodeksu postępowania / polityki, które regulują jej relacje ze sponsorem i niezależność od niego. Organ regulacyjny ocenia informacje finansowe zgodnie z przejrzystymi, określonymi z góry uregulowaniami. |
Wynagrodzenie
Należy mieć na uwadze, że w wielu sytuacjach pacjenci angażują się w działania dobrowolnie jako indywidualna osoba lub jako członek organizacji. Dlatego należy wziąć pod rozwagę następujące kwestie:
- wynagrodzenie za cały poświęcony czas i koszty;
- każde oferowane wynagrodzenie powinno być uczciwe i odpowiednie do rodzaju zaangażowania; najlepiej, aby koszty podróży były opłacane bezpośrednio przez organizatora, a nie zwracane;
- pokrycie kosztów poniesionych przez organizacje pacjentów podczas określania, którzy pacjenci są odpowiedni do zaangażowania w działania, i podczas udzielania im wsparcia ich (tj. grupy wsparcia, szkolenia i przygotowania);
- pomoc w organizowaniu logistycznej strony udziału pacjentów, w tym podróży i/lub zakwaterowania.
Wynagrodzenie obejmuje również pośrednie świadczenia rzeczowe (takie jak bezpłatne usługi świadczone przez organizacje pacjentów) oraz wszelkie inne niefinansowe świadczenia rzeczowe uzyskane przez pacjenta / organizację pacjentów (takie jak szkolenia czy zakładanie witryn internetowych).
Pisemna umowa
Pisemna umowna powinna jasno definiować co najmniej następujące kwestie: opis i cele działania, charakter interakcji podczas działania, zgoda (jeśli jest wymagana), ujawnienie, poufność, wynagrodzenie, poufność danych, zgodność, deklaracja konfliktu interesów, terminy. Interakcja może się odbywać wyłącznie na podstawie pisemnej umowy, która jako minimum określa podstawowe elementy współpracy (np. zasady angażowania, zgodność, własność intelektualna, płatności finansowe). Należy zadbać o to, aby pisemne umowy były przejrzyste i nie ograniczały właściwego udostępniania wiedzy.
Wdrożenie i monitorowanie
Ramy zaangażowania pacjentów można wdrażać stopniowo i/lub w stosownych przypadkach po etapie pilotażowym. Po pełnym wdrożeniu, kiedy pacjenci są już zaangażowani zarówno w problemy ogólne, jak i charakterystyczne dla produktu, i po utworzeniu puli organizacji i pacjentów jako indywidualnych ekspertów oraz na potrzeby forów interakcji, należy opracować publiczny roczny raport o interakcjach, obejmujący następujące kwestie:
- analiza wskaźników (definiowanych dla rodzaju interakcji) oceniających przydatność interakcji,
- opinie zwrotne od pacjentów i reprezentujących ich organizacji uzyskane poprzez ukierunkowane badania,
- opinie zwrotne uzyskane od samego organu regulacyjnego,
- przegląd działań prowadzonych z udziałem organizacji i pacjentów jako indywidualnych ekspertów,
- zaleca się sformułowanie sugestii na przyszłość, w tym strategii dla przyszłych interakcji z pacjentami.
Załącznik 1 – Schemat angażowania pacjentów w procesy regulacyjne – przykład EMA
- Pacjenci mogą brać udział w działaniach EMA w trakcie procedury rejestracyjnej w różny sposób.
Załącznik 2 – Przeanalizowane kodeksy postępowania
Istotne fundamenty niniejszych wytycznych mają swoje źródło w wielu uznanych kodeksach.
- The ECAB Protocol (description of and working procedures of ECAB (European Community Advisory Board, scientific working group at EATG, established 1997))
- Mandate, objectives and rules of procedure for the European Medicines Agency Human Scientific Committees’ Working Party with Patients' and Consumers' Organisations (PCWP) (30 May 2013)
- Minutes of EMA Human Scientific Committees’ Working Party with Patients’ and Consumers’ Organisations (PCWP) meeting with all eligible organisations (31 January 2014)
- 10 December 2009 EMA Reflection Paper on the Further Involvement of Patients and Consumers in the Agency’s Activities
- EMA leaflet on working with patients and consumers (updated 22/4/2015)
- EMA framework of interaction (revised 16 October 2014)
- Recommendations from ECAB meeting held in Bergen, Norway 1997EATG ECAB, “The impatient Patient - From Anger to Activism”A systematic review of the history, working models, relevance and perspectives of the European Community Advisory Board
- FDA Patient Representative Program
- FDA Patient-Focused Drug Development; The Voice of the Patient: A Series of Reports from FDA's Patient-Focused Drug Development Initiative
- FDA Patient-Focused Drug Development: Enhancing Benefit-Risk Assessment in Regulatory Decision-Making
- WMA Declaration of Helsinki - Ethical Principles for Medical Research Involving Human Subjects Retrieved 13 July, 2021, from https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/
Piśmiennictwo
- Adapted from the EMA framework. European Medicines Agency (2014) EMA/637573/2014. http://www.ema.europa.eu/docs/en_GB/document_library/Other/2009/12/WC500018013.pdf. Last Accessed 21.11.2016.
- Regulation (EC) No 726/2004 http://ec.europa.eu/health/files/eudralex/vol-1/reg_2004_726/reg_2004_726_en.pdf. Last Accessed 21.11.2016.
* W dialogu dotyczącym opieki zdrowotnej konsumenci są uznawani za strony zainteresowane. Działalność EUPATI skupia się na pacjentach, a nie na konsumentach. Odzwierciedlają to materiały edukacyjne i wytyczne.