Sådan fremstilles et lægemiddel. Trin 8: Verifikationsundersøgelser
Introduktion
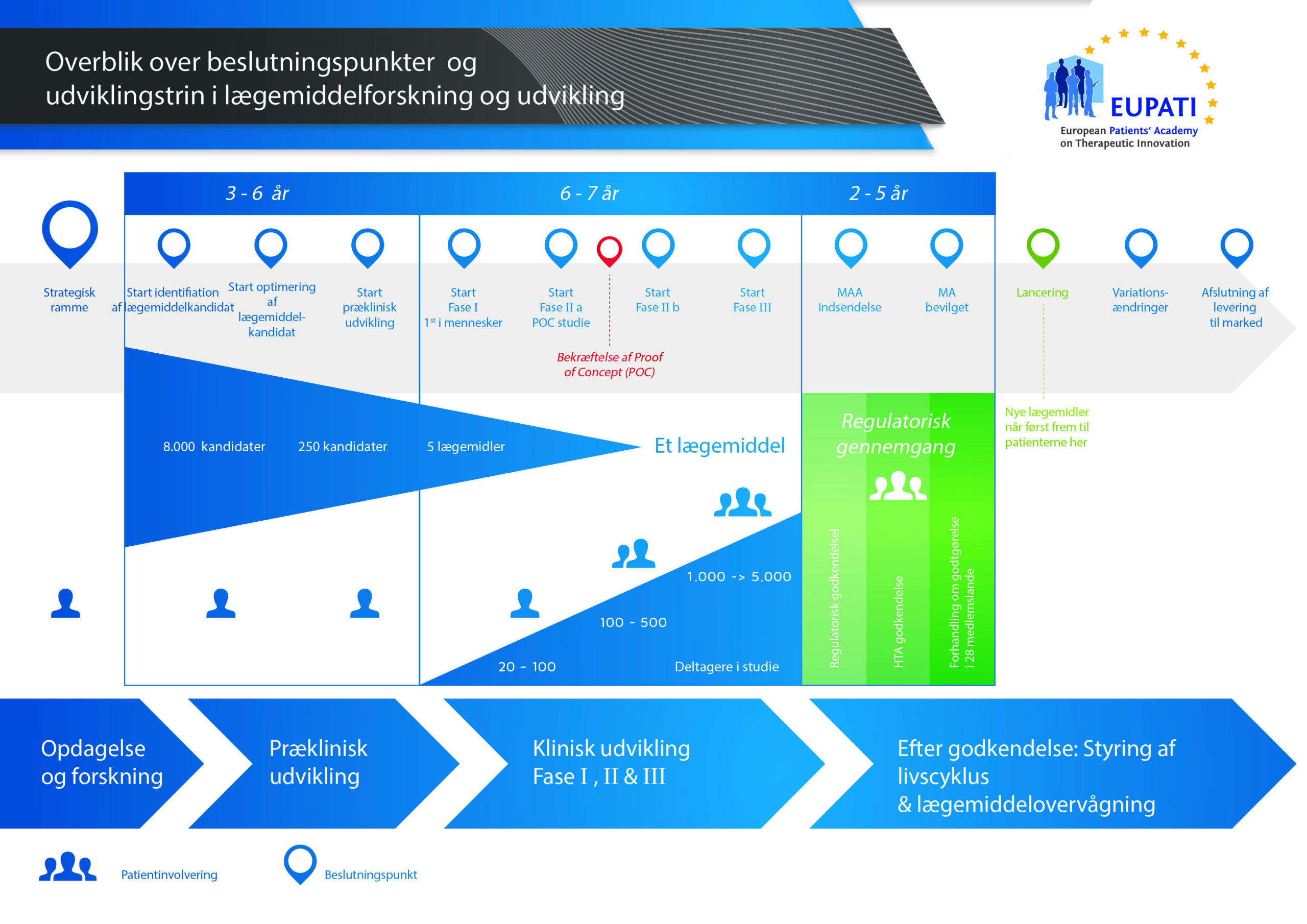
Det tager over 12 år og koster i gennemsnit over 1 milliarder kroner at gennemføre al den nødvendige forskning og udvikling, før et nyt lægemiddel er klar til brug for patienter.
Der er høj risiko forbundet med at udvikle lægemidler. De fleste stoffer (omkring 98 %), der udvikles, kommer aldrig på markedet som nye lægemidler. Det skyldes primært, at når man ser på fordelene og risiciene (de negative bivirkninger), i udviklingsfasen, kan de ikke matche de lægemidler, som patienterne allerede har adgang til.
Udviklingen af et nyt lægemiddel kan opdeles i 10 forskellige trin. Følgende artikel dækker trin 8: Verifikationsundersøgelser.
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Det kræver langt over 10 års omhyggelig planlægning og forskning, før et lægemiddel kan tages fra molekyle til behandling, der er klar til at komme på markedet.
Trin 8: Udvikling til lancering: Kliniske fase III-undersøgelser – verifikationsundersøgelser
Fase III-forsøg (også kaldet verifikationsundersøgelser) er den største, mest komplicerede og dyreste del af at udvikle et lægemiddel. De har til formål at bekræfte kandidatstoffets virkning og sikkerhed i en stor patientpopulation.
Beslutningen om at fortsætte til Fase III-forsøg træffes kun, hvis den understøttes af alle oplysningerne fra tidligere undersøgelser samt fremstillings- og forretningsenhederne. Designet af disse forsøg er også meget vigtige. Derfor er der omfattende diskussioner med eksterne eksperter, lægemiddelmyndigheder (i Danmark Lægemiddelstyrelsen), patientgrupper og andre, før fase III-forsøg starter. Det sikrer, at de rigtige spørgsmål bliver stillet, og at de rigtige oplysninger bliver indsamlet. Antallet af patienter i forsøget er også meget vigtigt, så resultaterne kan fortolkes korrekt og overholder kravene fra lægemiddelmyndighederne.
Alle de oplysninger, der er indsamlet i de tidligere stadier, bruges til at træffe vigtige beslutninger, herunder:
- lægemidlets endelige formulering (hvordan det aktive lægemiddel kombineres med andre kemiske stoffer)
- den dosis, der skal testes
- hvilke patienter der kan rekrutteres (inklusionskriterier)
- hvilke patienter der ikke kan inkluderes (eksklusionskriterier)
- hvor mange patienter der er brug for
- undersøgelsens design
- undersøgelsens længde
- hvordan virkningen og sikkerheden måles
- de statistiske test, der anvendes
På dette stadie kan forsøgene involvere flere tusinde patienter. Dette afhænger dog af, hvad lægemidlet skal behandle ("indikationen"). Fase III-forsøg kan f.eks. blive udført på mindre populationer, hvis indikationen er en usædvanlig lidelse.
Fase III-undersøgelser kan involvere flere tusinde patienter, blive afviklet i mange lande og kræve stor ekspertise for at blive udført effektivt. Derfor er de meget dyre og tidskrævende. Det er dog den eneste fremgangsmåde til at få et godt overblik over relationen mellem lægemidlets virkning (hvis det virker) og dets sikkerhed (om det er veltolereret), hvilket er meget vigtigt.
Fase III-forsøg udgør den største, mest komplicerede og dyreste del af processen til at udvikle et lægemiddel. Over 50 % af lægemidler består ikke denne fase. Samlet set ligger frekvensen for projekter, der begynder på forskningsstadiet og ikke opnår endelig godkendelse, på over 97 %. Indtægterne for de få lægemidler, der ender med at komme på markedet, dækker omkostningerne til alle projekterne – både succeserne og fiaskoerne.
Referencer
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bilag
A2-1.02.7-v1.1