Sådan fremstilles et lægemiddel. Trin 3 og 4: Udvælgelse af et molekyle eller en ledetråd
Introduktion
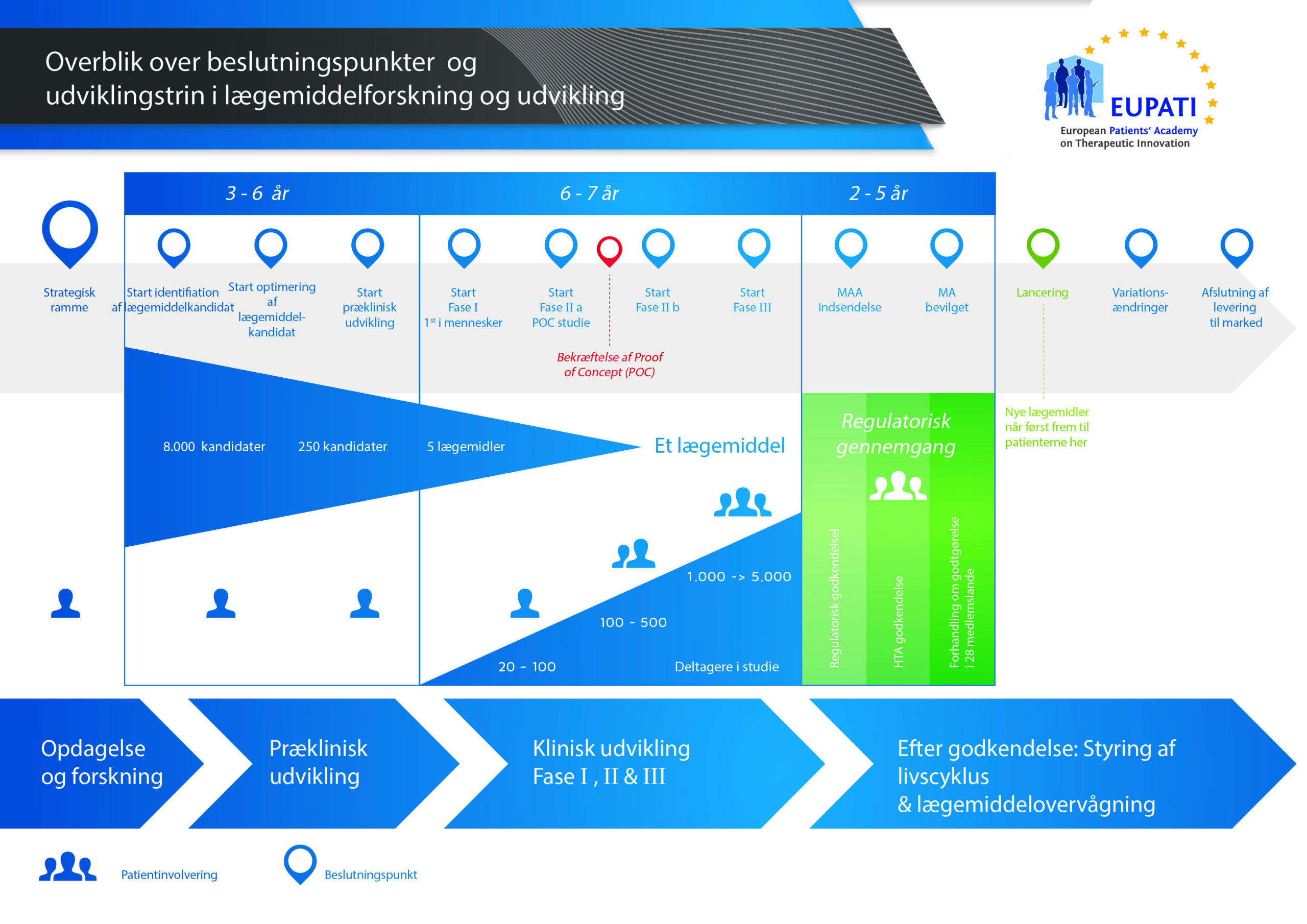
Det tager over 12 år og koster i gennemsnit over 1 milliarder kroner at gennemføre al den nødvendige forskning og udvikling, før et nyt lægemiddel er klar til brug for patienter.
Der er høj risiko forbundet med at udvikle lægemidler. De fleste stoffer (omkring 98 %), der udvikles, kommer aldrig på markedet som nye lægemidler. Det skyldes primært, at når man ser på fordelene og risiciene (de negative bivirkninger), i udviklingsfasen, kan de ikke matche de lægemidler, som patienterne allerede har adgang til.
Udviklingen af et nyt lægemiddel kan opdeles i 10 forskellige trin. Følgende artikel dækker trin 3 og 4: Generering og optimering af molekyler.
- Det kræver langt over 10 års omhyggelig planlægning og forskning, før et lægemiddel kan tages fra molekyle til behandling, der er klar til at komme på markedet.
Trin 3: Molekylegenerering
Dette trin består af at finde et molekyle, der interagerer med målet. Molekylet kan komme fra en naturlig kilde, f.eks. en plante, eller kan være udviklet af kemikere. De kaldes for "små molekyler". Mange hundredetusinde molekyler testes for at finde "ledetråde" – molekyler, der interagerer med målet. At teste for ledetråde kaldes en screeningproces. Moderne robotteknologi giver mulighed for "high-throughput screening". Det betyder, at flere millioner molekyler kan testes hurtigt. Når ledetrådene er genereret eller fundet, kan processen rykke videre til næste trin.
Det er også muligt at finde store molekyler (proteiner), der interagerer med målet. Disse store molekyler er meget mere komplicerede at fremstille. De produceres via bioteknologiprocesser og beskrives derfor som "biologiske lægemidler". I bioteknologi produceres de store molekyler af værtsceller i en levende organisme – f.eks. bakterier, gær eller dyreceller – i store gæringstanke. Proteinerne udskilles og rendyrkes herefter. De rendyrkede proteiner kan derefter bruges til at udforske interaktioner med målet.
Traditionelt set har medicinalindustrien produceret "små molekyler", som derefter blev udviklet som nye lægemidler. Nu om dage produceres der også store molekyler (proteiner) eller "biologiske lægemidler". Både små molekyler og biologiske lægemidler er vigtige i udviklingen af lægemidler.
Trin 4: Molekyleoptimering
Under molekyleoptimeringen foretages der ændringer i molekylerne for at forbedre deres effekt. Screeningprocessen identificerer "ledetråde" – molekyler, der interagerer med målet. Disse molekyler har dog ofte kun en svag effekt og er ikke velegnede til videreudvikling. Kemikere ændrer derfor det udvalgte "ledetråds"-molekyle ved at tilsætte eller fjerne elementer. Det skaber en række molekyler, der er en smule anderledes. Molekylet i et eksisterende lægemiddel kan også ændres med henblik på at opnå en forbedret eller anderledes effekt. Computerteknologi kan hjælpe med at designe disse molekyler.
Disse ændrede molekyler bliver derefter testet for at bestemme, hvilken struktur der har den bedste virkning og tolereres bedst (sikkerhed). Disse undersøgelser hjælper forskerne med at forstå molekylets farmakologi, hvilket vil sige den måde, hvorpå molekylet virker i kroppen. Molekylerne med bedre virkning og sikkerhed kan derefter gå videre til yderligere test som "lægemiddelkandidatstof". På dette tidspunkt bliver de videnskabelige og tekniske oplysninger om kandidatstoffet, f.eks. dets molekylestruktur og effekt, normalt registreret eller patenteret med henblik på at beskytte det ved at tage patent.
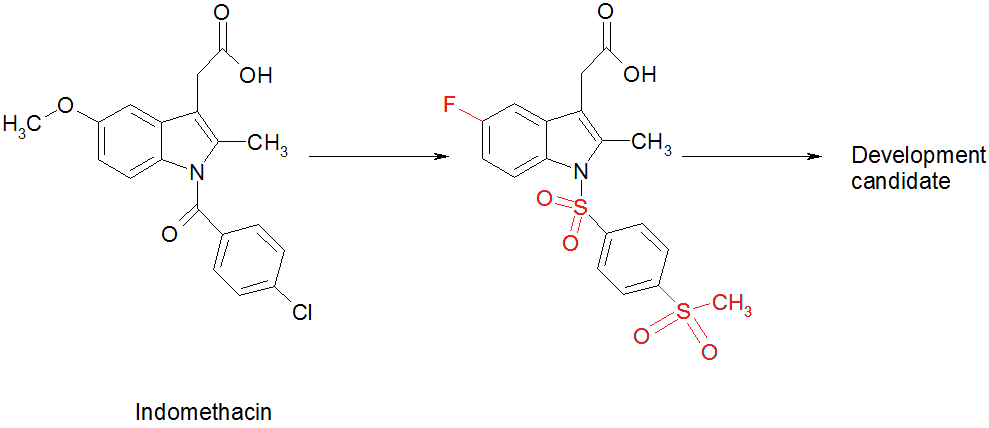
- Optimering af indomethacin til en potent CRTH2-antagonist. Det oprindelige molekyle til venstre (kaldet indomethacin) er blevet kemisk ændret (ændringerne vises med rødt) for at optimere det til et lægemiddelkandidatstof til et udviklingsprojekt.
Husk, at resultaterne fra en serie af eksperimenter bliver gennemgået i hver enkelt fase af udviklingsprocessen, og at der skal træffes en beslutning om, hvorvidt man skal gå videre. En beslutning om at gå videre betyder, at der skal foretages yderligere investeringer for at finansiere det næste sæt af eksperimenter. Hvis de oplysninger, der er indsamlet i løbet af eksperimenterne, ikke understøtter en fortsættelse, træffes der en beslutning om at stoppe projektet.
Sammenfatning: Trin 1-4
Et kandidatlægemiddel opstår kun, når det rigtige mål er blevet udvalgt, og det bedste molekyle er blevet identificeret til lægemidlet. I denne fase har processen til forskning i lægemidler:
- i gennemsnit varet i 4,5 år
- involveret test af et stort antal molekyler (5.000 til 10.000 – eller flere i tilfælde af små molekyler) og
- kostet ca. 3,7 milliarder kroner i gennemsnit.
Kandidatstoffet kan enten være et lille molekyle eller et biologisk lægemiddel.
Referencer
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bilag
A2-1.02.3-V1.1