Sådan fremstilles et lægemiddel. Trin 10: Livscyklusstyring
Introduktion
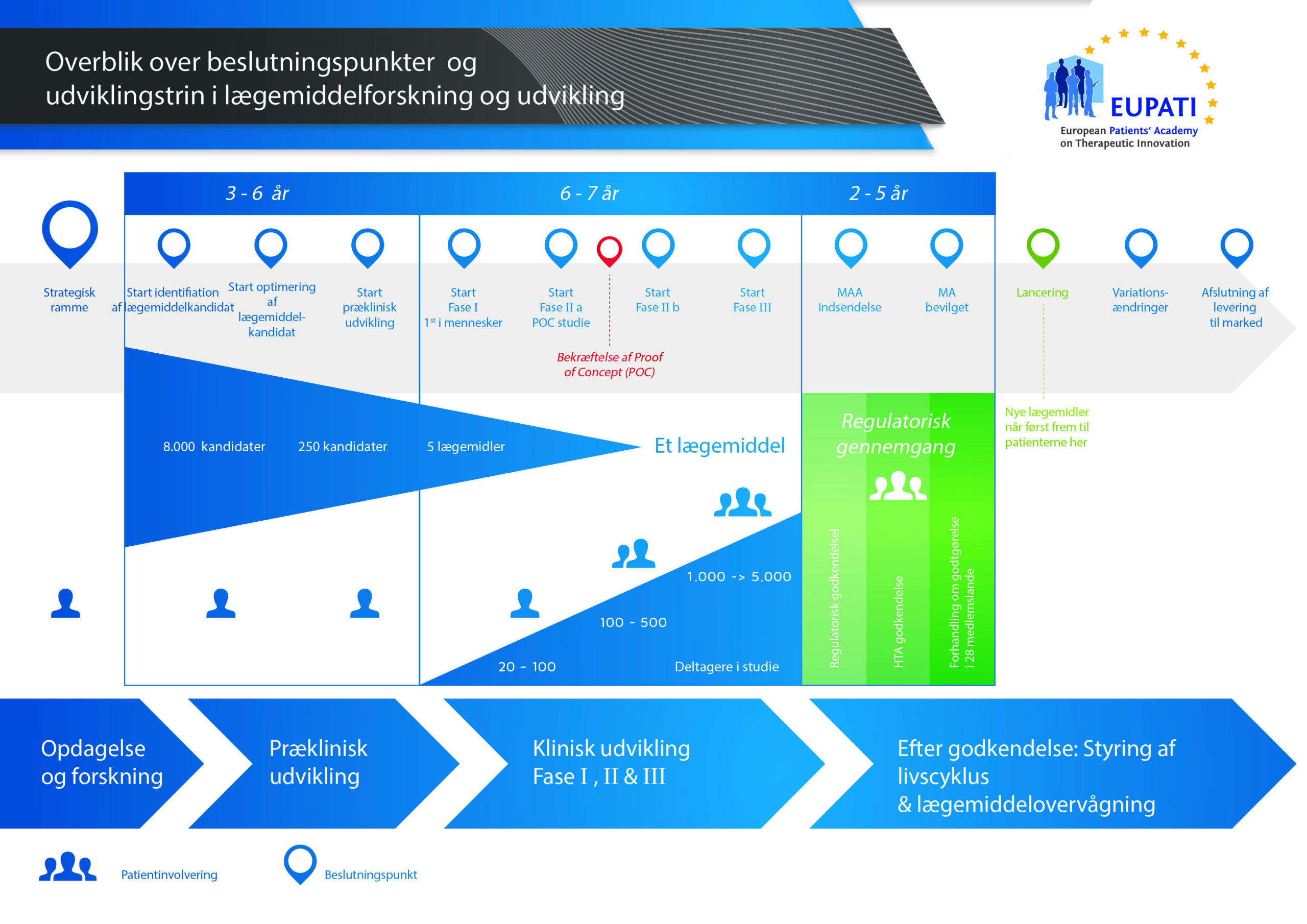
Det tager over 12 år og koster i gennemsnit over 1 milliarder kroner at gennemføre al den nødvendige forskning og udvikling, før et nyt lægemiddel er klar til brug for patienter.
Der er høj risiko forbundet med at udvikle lægemidler. De fleste stoffer (omkring 98 %), der udvikles, kommer aldrig på markedet som nye lægemidler. Det skyldes primært, at når man ser på fordelene og risiciene (de negative bivirkninger), i udviklingsfasen, kan de ikke matche de lægemidler, som patienterne allerede har adgang til.
Udviklingen af et nyt lægemiddel kan opdeles i 10 forskellige trin. Følgende artikel dækker trin 10: Sikkerhedsovervågning ved markedsføring og efter markedsføring samt livscyklusstyring.
- Det kræver langt over 10 års omhyggelig planlægning og forskning, før et lægemiddel kan tages fra molekyle til behandling, der er klar til at komme på markedet.
Sikkerhedsovervågning ved markedsføring og efter markedsføring
I marketingprocessen deles oplysninger om det nye lægemiddel med læger og andet sundhedspersonale, så de bliver opmærksomme på det nye lægemiddels virkning og kan ordinere det i tilfælde, hvor de mener, at det kan komme patienterne til gode.
Udviklingsprocessen stopper dog ikke der. Det er stadig nødvendigt at indsamle og analysere oplysningerne om lægemidlets sikkerhed, når det bruges "i det virkelige liv" (kaldet "lægemiddelovervågning"). Det skyldes følgende:
- I kliniske forsøg (som er designet til at give klare svar) har patienter ideelt set kun den sygdom, der undersøges for, og tager ikke andre former for lægemidler.
- I virkeligheden tager et stort antal patienter det nye lægemiddel. De kan have flere andre sygdomme og tager en række andre lægemidler.
Det er nødvendigt at indsamle data både fra kliniske forsøg og fra det virkelige liv for at få en fuld forståelse af det reelle forhold mellem risici og fordele af lægemidlet.
Livscyklusstyring
Når et lægemiddel er kommet på markedet, fortsætter udviklingsprocessen med at udforske:
- andre mulige anvendelsesformål (indikationer) for lægemidlet. Hvis det oprindelige anvendelsesformål f.eks. var til patienter med astma, kunne en ny indikation måske være til patienter med en anden type lungesygdom, f.eks. kronisk obstruktiv lungesygdom.
- forbedret metode til at fremstille og bruge lægemidlet (nye formuleringer). Det kan f.eks. være en særlig formulering til børn.
Alle disse aktiviteter er kendt som "livscyklusstyring".
Andre ændringer i et lægemiddels livscyklus
Når et lægemiddel kommer på markedet for første gang, er det beskyttet af et "patent". Det betyder, at andre virksomheder ikke må sende et lignende lægemiddel på markedet. Når patentet eller databeskyttelsesperioden er udløbet, vil andre virksomheder fremstille og sende det samme produkt på markedet. Når det sker, kaldes produktet for et "generisk" produkt.
Nye lægemidler er normalt licenseret som receptpligtige lægemidler. Det betyder, at sundhedspersonale kan føre tilsyn med brugen i de første par år. Når det vurderes passende og sikkert, kan lægemidlet derefter blive gjort tilgængeligt som et håndkøbslægemiddel. Dette involverer en ændring i lægemidlets regeludstedelsesstatus, og der skal udstedes en ny licens. Patienter kan købe håndkøbslægemidlet direkte på apoteket eller i supermarkedet (afhængigt af dit land).
Referencer
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bilag
A2-1.02.9-v1.1