Sådan fremstilles et lægemiddel. Trin 1: Tidlig forskning
Det tager over 12 år og koster i gennemsnit over 1 milliarder kroner at gennemføre al den nødvendige forskning og udvikling, før et nyt lægemiddel er klar til brug for patienter.
Der er høj risiko forbundet med at udvikle lægemidler. De fleste stoffer (omkring 98 %), der udvikles, kommer aldrig på markedet som nye lægemidler. Det skyldes primært, at de fordele og risici (de negative bivirkninger), der findes i udviklingsfasen, ikke står mål med de lægemidler, som patienterne allerede har adgang til.
Udviklingen af et nyt lægemiddel kan opdeles i 10 forskellige trin. Følgende artikel dækker trin 1: Tidlig forskning.
- Det kræver langt over 10 års omhyggelig planlægning og forskning, før et lægemiddel kan tages fra molekyle til behandling, der er klar til at komme på markedet.
Trin 1: Tidlig forskning
Bestemmelse af, om der er et "uopfyldt behov". I den tidlige forskningsfase arbejder videnskabsfolk i det akademiske miljø (universiteter) og i medicinalindustrien (medicinalvirksomheder) på at forstå sygdommen.
Et uopfyldt behov henviser til en sygdom, hvor der enten:
- ikke findes et velegnet lægemiddel eller
- findes et lægemiddel, men nogle patienter oplever muligvis uacceptable bivirkninger og kan ikke tage det.
I forsknings- og udviklingsprocessen bruges der mange ressourcer og penge. Virksomheder starter ofte kun et nyt program op for at imødegå et uopfyldt behov, hvis det giver kommerciel mening at gøre det. Det skyldes, at virksomhederne er nødt til at kunne tjene penge på det nye lægemiddel for at dække udviklingsomkostningerne og for at investere i projekter til forskning i nye lægemidler. Der er mange uopfyldte behov, som der i øjeblikket ikke udvikles nye lægemidler til. Lovgiverne i EU er opmærksomme på dette, og de tilbyder incitamenter og belønninger for at støtte udviklingen af lægemidler i de vanskeligere sager, f.eks. til børn eller patienter med sjældne sygdomme.
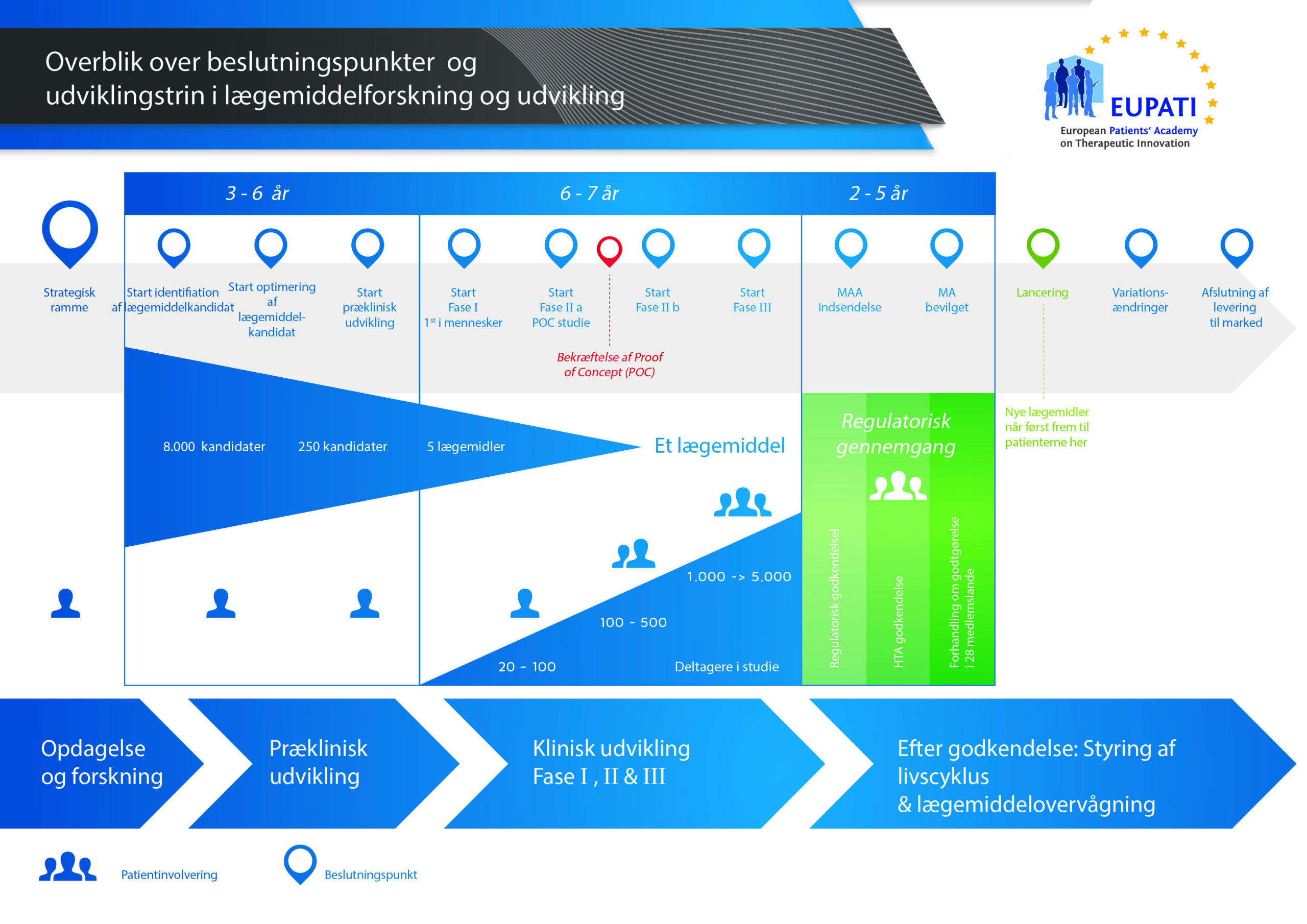
De grundlæggende trin i udviklingen af lægemidler er vist i diagrammet. Et vigtigt trin er indsendelsen af en godkendelsesansøgning til lægemiddelmyndighederne og godkendelsesprocessen, som skal falde positivt ud, før lægemidlet kan markedsføres (lanceres). Det er dog ikke op til virksomheden, om denne godkendelsesproces falder positivt ud eller ej.
I hvert trin i processen til udvikling af et lægemiddel skal der indgås en aftale om midlerne (investeringen) og med de personer, der skal udføre arbejdet – også kaldet en "investeringsbeslutning". Resultaterne af hvert trin bliver derefter gennemgået, før næste aktivitet kan gå i gang. Dette mønster med investeringsbeslutning – aktivitet – resultater – investeringsbeslutning fortsætter gennem hele udviklingsprocessen. Det betyder, at projektet bliver stoppet, hvis resultaterne på et hvilket som helst tidspunkt er utilfredsstillende. De økonomiske og menneskelige ressourcer kan derefter bruges på andre projekter.
Referencer
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bilag
A2-1.02.1-V1.1