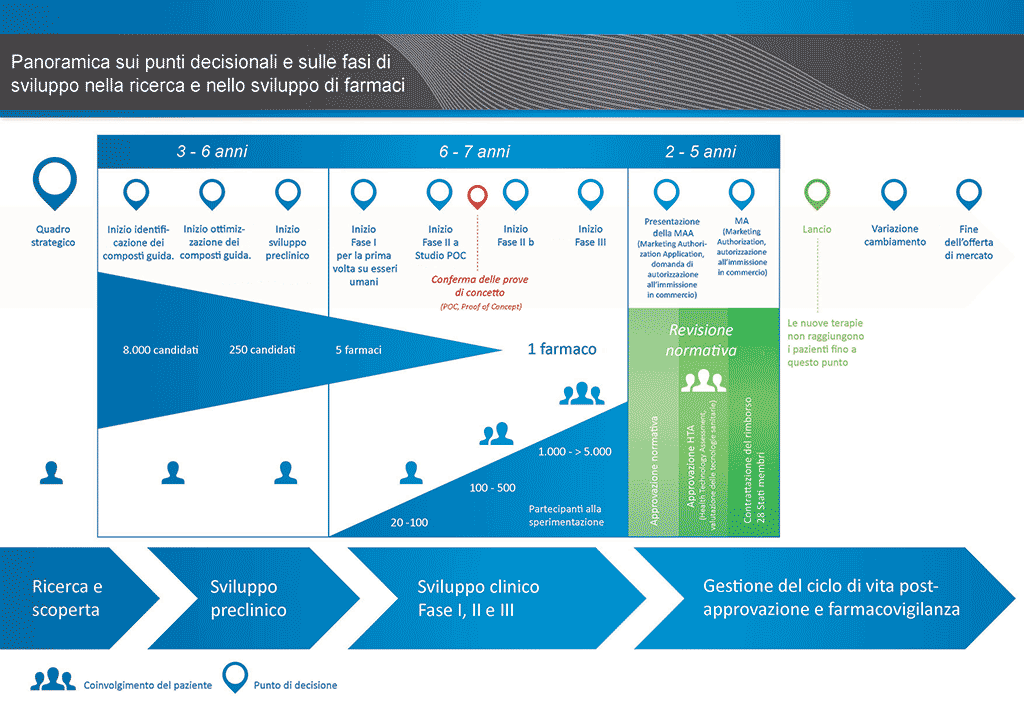
Realizzare un farmaco. Fase 7: Fase II – prova di concetto
Introduzione
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché osservando i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo, non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 7: prova di concetto – studi clinici di Fase II.
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Fase 7: Prova di concetto – Studi clinici di Fase II
Studi su pazienti. Una volta che i risultati dello studio su volontari hanno mostrato che è sicuro procedere, la fase successiva prevede l'avvio di studi clinici su pazienti affetti dalla malattia che viene trattata. A questi studi clinici si applicano le stesse linee guida e gli stessi regolamenti degli studi di Fase I.
Negli studi di Fase II e Fase III, vi sono di solito due gruppi di trattamento. Un gruppo riceve il farmaco attivo e l'altro gruppo il miglior trattamento attualmente disponibile o un farmaco fittizio che non ha effetti sull'organismo (chiamato "placebo"). Tali studi sono generalmente "in doppio cieco", randomizzati", "controllati con placebo".
- "In doppio cieco" significa che sia il medico che il partecipante non conoscono chi riceve il farmaco attivo o il miglior trattamento attualmente disponibile/il placebo.
- "Randomizzato" significa che i gruppi di trattamento sono scelti a caso. La scelta viene effettuata tramite un computer che genera un codice casuale. Essa non può essere influenzata né dal medico né da chiunque altro.
- "Controllato con placebo" significa che alcuni partecipanti riceveranno un placebo somministrato nelle stesse esatte condizioni del farmaco attivo. Ciò permette di separare gli effetti correlati alla malattia. Ad esempio, se un partecipante a uno studio si lamenta di mal di testa, è importante sapere se è esso è correlato a un farmaco attivo. Se lo stesso numero di partecipanti che riceve il placebo lamenta un mal di testa, ciò indica che il mal di testa non può essere dovuto soltanto al farmaco attivo.
Tutti i dettagli dello studio sono descritti nel protocollo di studio e le informazioni vengono inserite nella scheda raccolta dati (CRF, Case Record Form). I risultati sono quindi analizzati utilizzando test statistici.
Queste sperimentazioni sono di solito condotte in un numero di pazienti da 100 a 500. Sono progettate per ottenere informazioni sull'effetto del farmaco sulla malattia effettiva ("prova di concetto"). Questa è anche la fase in cui vengono utilizzate diverse dosi di farmaco per individuare qual è la migliore. Questa dose viene quindi utilizzata per la fase successiva in più ampi studi clinici.
Quante più informazioni possono essere apprese a questo stadio circa l'effetto nei pazienti, tanto è più facile decidere se lo sviluppo deve continuare. Tuttavia, gli studi di Fase II sono troppo contenuti per essere in grado di fornire prove sufficienti circa l'efficacia e la sicurezza. Pertanto, è importante raccogliere sempre più informazioni sul modo in cui il farmaco funziona nei pazienti, al fine di ridurre il rischio d'insuccesso allo stadio successivo (Fase III o sviluppo per il lancio), la fase più costosa e più complicata dello sviluppo
Al contrario degli studi di Fase I, eseguiti di solito in speciali unità, tali studi di Fase II sono svolti su pazienti e di conseguenza vengono condotti in diversi sedi ospedaliere da medici, chiamati sperimentatori, che lavorano regolarmente in centri di questo tipo.
Condurre sperimentazioni in parecchie sedi differenti allo stesso tempo è più complicato che condurre una sperimentazione in una singola sede.
- Tutti gli sperimentatori e il personale infermieristico dello studio devono essere formati utilizzando un protocollo stabilito, in modo che sia eseguito allo stesso modo in tutti i centri.
- Il farmaco deve essere esportato in paesi differenti e conservato in modo appropriato in diverse farmacie.
- I campioni di sangue raccolti da pazienti negli studi clinici sono di solito inviati a un singolo laboratorio centrale.
- Devono essere comprese e seguite tutte le norme e regolamenti locali del paese.
- In ciascuna nazione sono necessari il parere del comitato etico e l'approvazione da parte dell'autorità nazionale competente (NCA, National Competent Authority).
Tutte queste attività devono essere coordinate dal personale internazionale dello studio.
Riepilogo: Fasi 1-7
Entro la fine degli studi di Fase II, il programma:
- avrà richiesto in media 8 anni e mezzo e
- sarà costato in media 1 miliardo di euro.
Per ogni 10 farmaci analizzati nella Fase I e nella Fase II, solo due (in media) proseguiranno nella fase successiva
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Allegati
#mla_gallery-2 { margin: auto; width: 100%; } #mla_gallery-2 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-2 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-2 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Scheda informativa: prova di concetto
Size: 97,972 bytes, Format: .docx
Questa scheda informativa si occupa degli studi clinici di fase II o studi di prova di concetto. Sono svolti su un numero limitato di pazienti affetti dalla malattia target, al fine di accertare che il composto candidato abbia su di essa l’effetto desiderato.
#mla_gallery-3 { margin: auto; width: 100%; } #mla_gallery-3 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-3 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-3 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.6-v1.1