Realizzare un farmaco. Fase 3 e 4: selezione di una molecola o composto guida
Introduzione
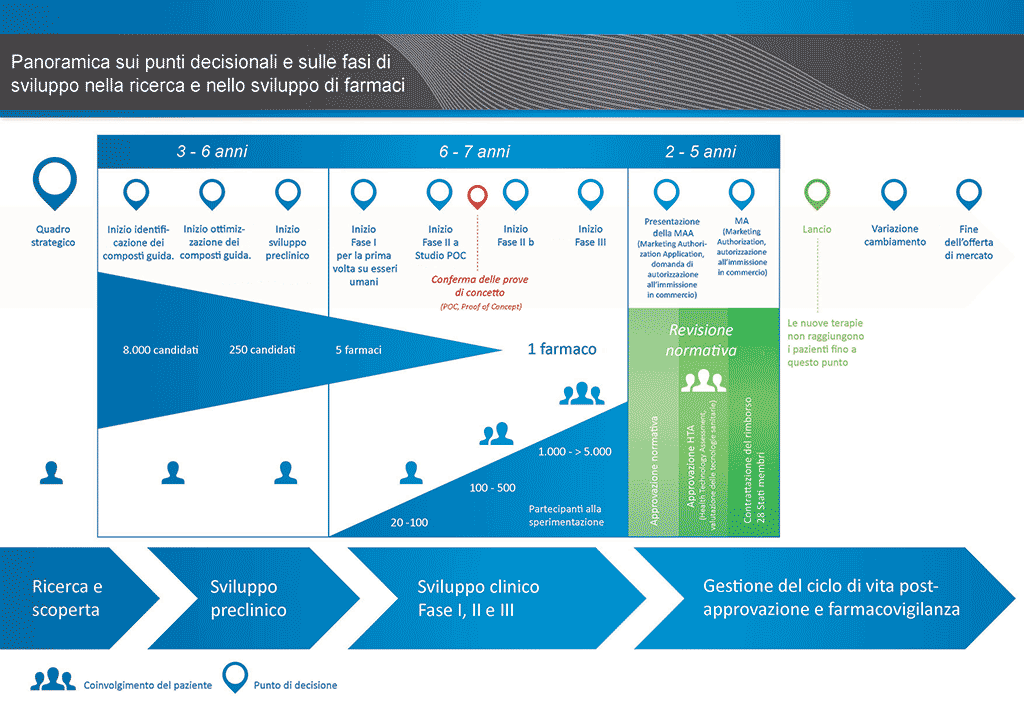
Sono necessari più di 12 anni e in media più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti.
Lo sviluppo di farmaci è un’impresa ad alto rischio. La maggioranza (circa il 98%) delle sostanze sviluppate non riesce ad arrivare sul mercato come nuovo medicinale. Ciò accade soprattutto perché osservando i benefici e i rischi (effetti collaterali negativi) riscontrati durante lo sviluppo, non sono comparabili positivamente rispetto ai farmaci già disponibili per i pazienti.
Lo sviluppo di un nuovo farmaco può essere suddiviso in 10 fasi diverse. Il seguente articolo si occupa della Fase 3 e 4: generazione e ottimizzazione dei composti guida.
- Occorrono oltre 10 anni di attenta pianificazione e ricerca perché un farmaco passi da molecola a trattamento disponibile sul mercato.
Fase 3: Generazione dei composti guida
Questa fase consiste nell'individuare una molecola che interagirà con il target. Tale molecola potrebbe provenire da una fonte naturale, ad esempio una pianta, o potrebbe essere stata sintetizzata in laboratorio. Queste sono chiamate "piccole molecole". Centinaia di migliaia di molecole saranno studiate per individuare i ”composti guida”, cioè quelle che interagiscono con il target. Il test per l'individuazione dei composti guida è chiamato processo di screening. La moderna tecnologia robotica permette uno screening "ad alte prestazioni". Ciò vuol dire che possono essere studiate in modo rapido milioni di molecole. Una volta che sono stati generati o individuati i composti guida, il processo può passare alla fase successiva.
È possibile anche individuare grandi molecole (proteine) che interagiscono con il target. Queste grandi molecole sono molto più complicate da produrre. Vengono prodotte tramite processi di biotecnologia e sono perciò descritte come "agenti biologici". In biotecnologia, le grandi molecole sono prodotte da cellule ospiti di un organismo vivente, come batteri, lieviti o cellule animali, in vasche di fermentazione di ampie dimensioni. Le proteine vengono quindi separate e purificate. Le proteine purificate possono essere utilizzate per studiare le interazioni con il target.
Tradizionalmente l'industria farmaceutica produceva "piccole molecole" che venivano poi sviluppate come nuovi farmaci. Attualmente, vengono prodotte grandi molecole (proteine) o "agenti biologici". Sia le piccole molecole sia gli agenti biologici sono importanti nello sviluppo di farmaci.
Fase 4: ottimizzazione dei composti guida
Durante l'ottimizzazione dei composti guida, le molecole vengono modificate al fine di migliorarne gli effetti Il processo di screening identifica "i composti guida", cioè le molecole che interagiscono con il target. Tuttavia, queste molecole spesso hanno solo un effetto debole e non sarebbero adatte per un ulteriore sviluppo. I chimici alterano quindi le molecole di "composti guida" selezionate aggiungendo o eliminando elementi. In questo modo si genera una gamma di molecole leggermente diverse. La molecola di un farmaco esistente potrebbe anche essere modificata per migliorarne o variarne gli effetti. La tecnologia computerizzata può aiutare a progettare queste molecole.
Queste molecole modificate saranno poi studiate per determinare quale struttura abbia la migliore efficacia e risulti meglio tollerata (sicurezza). Tali studi aiutano gli scienziati ad approfondire la comprensione della farmacologia della molecola, vale a dire della modalità d'azione della molecola nell'organismo. Le molecole con la migliore efficacia e sicurezza possono quindi passare a ulteriori studi come "candidato farmaco". Durante questa fase, le informazioni scientifiche e tecniche riguardo al composto candidato, come la sua struttura molecolare e gli effetti, sono di solito registrate o brevettate per proteggere la loro proprietà intellettuale.
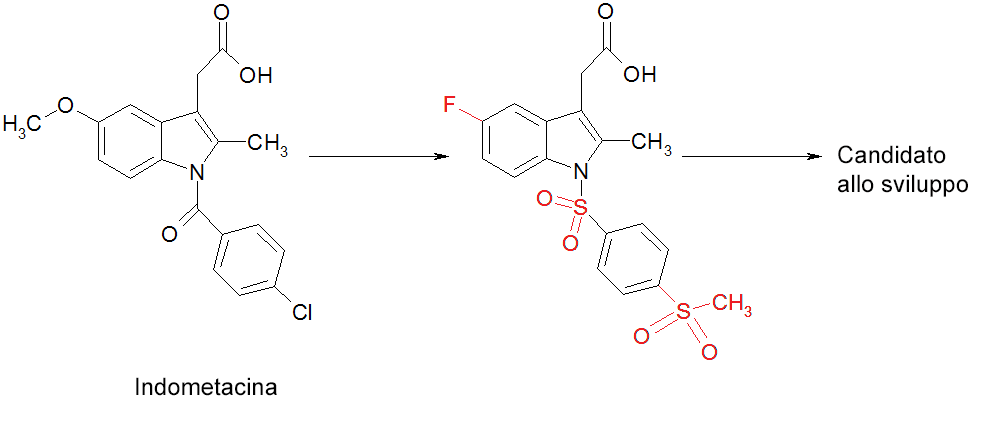
- Ottimizzazione di indometacina in un potente antagonista CRTH2. La molecola originaria sulla sinistra (chiamata indometacina) è stata alterata chimicamente (i cambiamenti sono mostrati nei cerchi rossi) per trasformarla in un candidato farmaco per un progetto di sviluppo.
Va ricordato che a ogni stadio del processo di sviluppo i risultati provenienti da una serie di esperimenti sono riesaminati e deve essere presa una decisione se procedere o meno. Se si decide di procedere, sarà necessario effettuare ulteriori investimenti per finanziare la fase successiva di esperimenti. Se le informazioni raccolte durante gli esperimenti non danno supporto alla continuazione del lavoro, viene presa una decisione di "non proseguimento" e il progetto viene interrotto.
Riepilogo: Fasi 1-4
Un "candidato farmaco" emerge solo una volta che il giusto target è stato selezionato e il migliore composto guida è stato identificato. A questo stadio, il processo di scoperta del farmaco:
- avrà richiesto in media 4 anni e mezzo,
- comprenderà un grande numero di molecole (da 5.000 a 10.000, o un numero maggiore per le piccole molecole) e
- sarà costato in media 500 milioni di euro.
Il composto candidato può essere una piccola molecola o un agente biologico.
Riferimenti bibliografici
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Allegati
- Scheda informativa: scoperta di un farmaco
Size: 1,204,035 bytes, Format: .docx
Scoperta di un farmaco. Questa scheda informativa si occupa delle fasi della scoperta e del processo di sviluppo di farmaci che hanno luogo prima che un composto venga studiato in esseri umani, dalla pre-scoperta (raccolta d’informazioni su una malattia) a studi non clinici di sicurezza in animali.
- Presentazione: i principi di base relativi alla scoperta e allo sviluppo di farmaci
Size: 877,906 bytes, Format: .pptx
I principi di base relativi alla scoperta e allo sviluppo di farmaci. Sono necessari più di 12 anni e più di 1 miliardo di euro per condurre tutte le ricerche e lo sviluppo richiesti prima che un nuovo medicinale sia disponibile per l’uso da parte dei pazienti. Questa presentazione spiega in dettaglio il percorso a partire dalla scoperta fino all’immissione sul mercato di un nuovo farmaco e oltre.
A2-1.02.3-V1.1