Preparatyka galenowa: opracowywanie leków
Wytwarzanie produktów galenowych jest procesem zmieniającym aktywny składnik w gotowy do stosowania lek, który można podawać zgodnie z wymaganiami. Wytwarzanie produktów galenowych obejmuje zasady przygotowywania i sporządzania leków wcelu optymalizacji ich wchłaniania. Jest to dział farmacji, dziedzina (lub nauką) zajmująca się projektowaniem postaci leku.
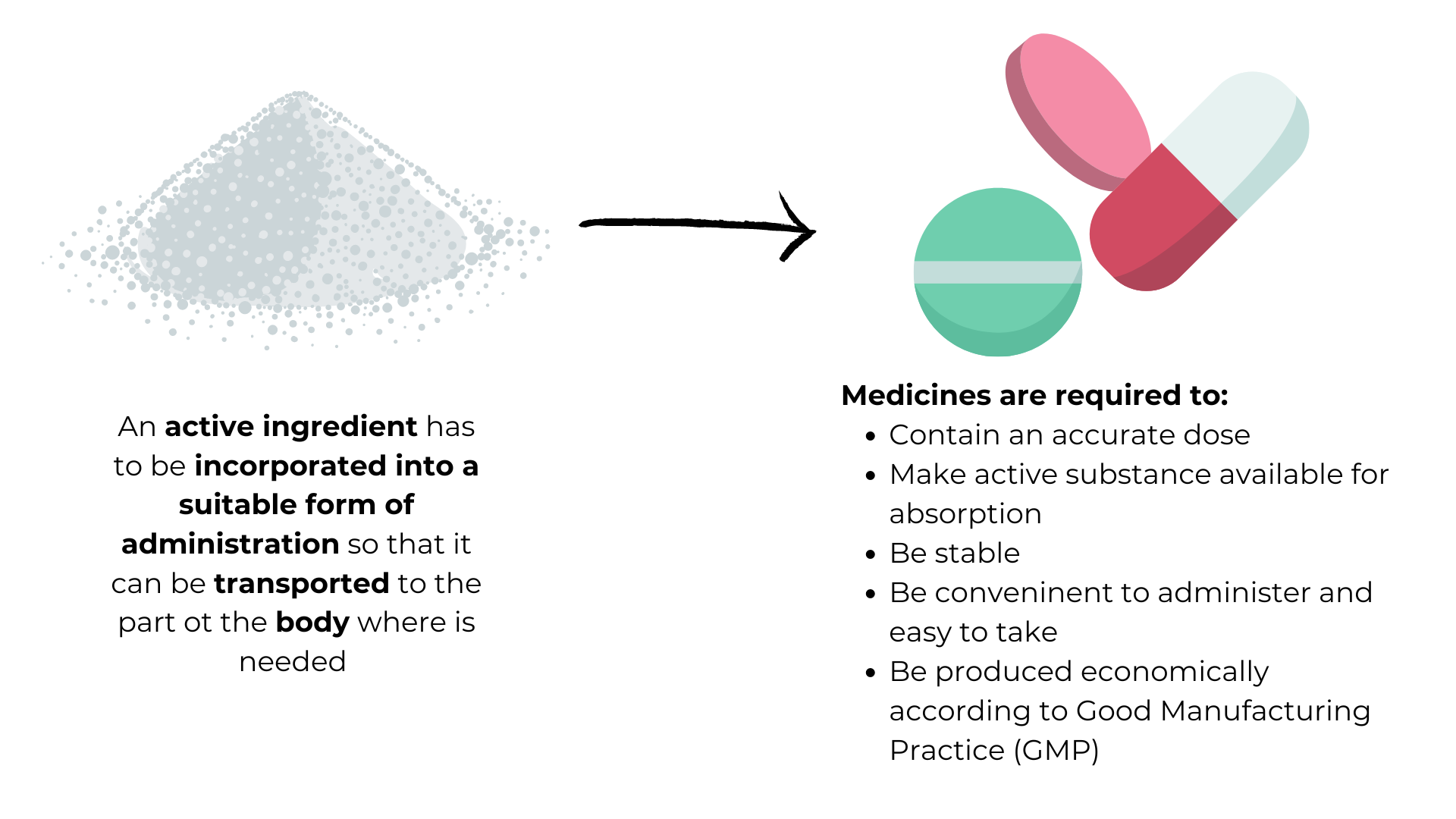
- Schematyczne przedstawienie preparatyki galenowej – wbudowanie składnika aktywnego w gotowe leki gotowe do podania – oraz wymagania, które takie leki muszą spełnić.
Substancja aktywna jest konieczna do opracowania postaci leku, badań oceniających bezpieczeństwo stosowania i badań klinicznych. Odpowiednia ilość wysokiej jakości substancji aktywnej jest wytwarzana w procesie opracowania chemicznego w celu wykorzystania w badaniach bezpieczeństwa stosowania oraz dla naukowców tworzących produkt medyczny.
Produkt medyczny składa się z substancji aktywnej w określonej postaci (tabletka, krem, zawiesina,roztwór), substancji pomocniczych (nieaktywnych składników takich jak laktoza) i opakowania/urządzenia do podawania (blister, butelka, inhalator, fiolka, fabrycznie wypełniona strzykawka).
Preparatyka galenowa na potrzeby badań nieklinicznych:
Celem nieklinicznych badań bezpieczeństwa stosowania jest:
- Badanie reakcji na lek aż do jego maksymalnych tolerowanych dawek
- Wykrywanie potencjalnych zagrożeń
- Generowanie danych wystarczających do sporządzenia oceny ryzyka
- Pomoc w wyborze dawki do wstępnych badań klinicznych
- Sugerowanie „markerów” do monitorowania bezpieczeństwa stosowania u ludzi
- Zapewnianie podstaw dla celowanych badań specjalistycznych
Jednak takie badania bezpieczeństwa nie muszą gwarantować bezpieczeństwa stosowania u ludzi ani prognozować ludzkich reakcji. Testowanie bezpieczeństwa pozwala określić margines bezpieczeństwa stosowania na podstawie danych dotyczących zwierząt i ludzi. Obszar zainteresowań badań tego rodzaju stanowią:
- podana dawka,
- rozmiar i czas trwania ekspozycji ustrojowej,
- dzienna ekspozycja ustrojowa,
- ekspozycja na metabolity oraz ich rodzaj, a także
- ekspozycja narządów docelowych.
Testowanie bezpieczeństwa stosowania dotyczy zarówno substancji aktywnej, jak i wszystkich substancji powiązanych, rozpuszczalników, produktów rozpadu, substancji pomocniczych i innych materiałów aktywnych oraz substancji ekstrakcyjnych wchodzących w skład postaci końcowej.
Preparatyka galenowa na potrzeby badań klinicznych
Do czynników branych pod uwagę w trakcie opracowywania odpowiedniej formy podawania należą akceptacja pacjenta i szczególne wymagania danego składnika aktywnego. Składniki nieaktywne lub substancje pomocnicze mogą stanowić większość masy leku i służą jako nośniki składnika aktywnego. Na przykład w tabletkach stosuje się skrobię kukurydzianą lub laktozę, w maściach natomiast emulsje wody i oleju.
Forma podawania wpływa także na wchłanianie, dostępność substancji aktywnej, a tym samym na efekt leczniczy leku. Decyduje ona o sposobie dostarczenia do organizmu substancji aktywnej, miejscu jej uwalniania i wielkości dawki, a także o czasie potrzebnym na wchłonięcie. Ponadto sposób podawania musi gwarantować, że pacjent będzie w stanie bezpiecznie dawkować lek i obchodzić się z nim z łatwością.
Naukowcy zajmujący się tworzeniem leków zapewniają, że substancja zostanie wchłonięta przez organizm, a dawka terapeutyczna osiągnie narząd docelowy. Nie każda substancja aktywna może być podawana jako tabletka, a szczególne wymagania dotyczące formy podawania (wstrzyknięcie do oka, produkty do inhalacji lub tabletki rozpuszczające się w ustach pacjenta) regularnie stawiają przez naukowcami nowe wyzwania.
Dobra Praktyka Produkcyjna (GMP)
Wszystkie leki podawane ludziom, także generyczne i biopodobne, powinny być wytwarzane zgodnie z zasadami Dobrej Praktyki Produkcyjnej (GMP).
Zasady GMP stanowią wskazówki dotyczące produkcji, testowania i kontroli jakości, których realizacja pozwala zapewnić, że lek jest bezpieczny dla ludzi. W wielu krajach istnieją specjalnie przepisy prawa i regulacje nakładające na producentów w sektorze farmacji i urządzeń medycznych obowiązek przestrzegania procedur GMP. Większość regulacji opiera się na międzynarodowych uzgodnieniach.
Wskazówki dotyczące GMP są zgodne z kilkoma podstawowymi zasadami:
- Higiena: produkcja farmaceutyczna musi się odbywać w czystych i higienicznych miejscach.
- Kontrolowane warunki środowiskowe w celu niedopuszczenia do zakażenia krzyżowego produktu medycznego przez inny składnik lub inne cząsteczki stałe, co może spowodować, że lek stanie się niebezpieczny dla człowieka.
- Jasno zdefiniowane i kontrolowane procesy produkcyjne:
- Wszystkie procesy o znaczeniu krytycznym są weryfikowane w celu zapewnienia spójności i zgodności ze specyfikacjami.
- Wszelkie zmiany procesu są oceniane.
- Zmiany mające wpływ na jakość leku są bezwzględnie weryfikowane.
- Instrukcje i procedury są zapisane w sposób przejrzysty i jednoznaczny. (Dobre praktyki dotyczące dokumentacji — GDP).
- Operatorzy są przeszkoleni w zakresie przeprowadzania i dokumentowania procesów.
- Rejestry są sporządzane podczas produkcji ręcznie lub za pomocą urządzeń, aby potwierdzić wykonanie wszystkich czynności wymaganych w ramach zdefiniowanej procedury i przestrzeganie instrukcji, a także zgodną z oczekiwaniami ilość i jakość leku.
- Odstępstwa są badane i dokumentowane.
- Rejestry produkcyjne (z uwzględnieniem dystrybucji) umożliwiające śledzenie pełnej historii partii są zachowywane w pełnej i dostępnej postaci.
- Dystrybucja leków minimalizuje wszelkie zagrożenia dla ich jakości.
- Jest dostępny system umożliwiający wycofanie każdej partii leku ze sprzedaży lub dostawy.
- Zażalenia dotyczące leków wprowadzonych do obrotu są badane podobnie jak przyczyny nieprawidłowości, a odpowiednie działania są podejmowane zarówno w odniesieniu do wadliwych leków, jak i w celu zapobieżenia podobnym sytuacjom w przyszłości.
Inne materiały
- Wskazówki WHO dotyczące Dobrej Praktyki Produkcyjnej (GMP) w UE
- Wskazówki WHO dotyczące Dobrej Praktyki Produkcyjnej (GMP)
A2-2.06-V1.4