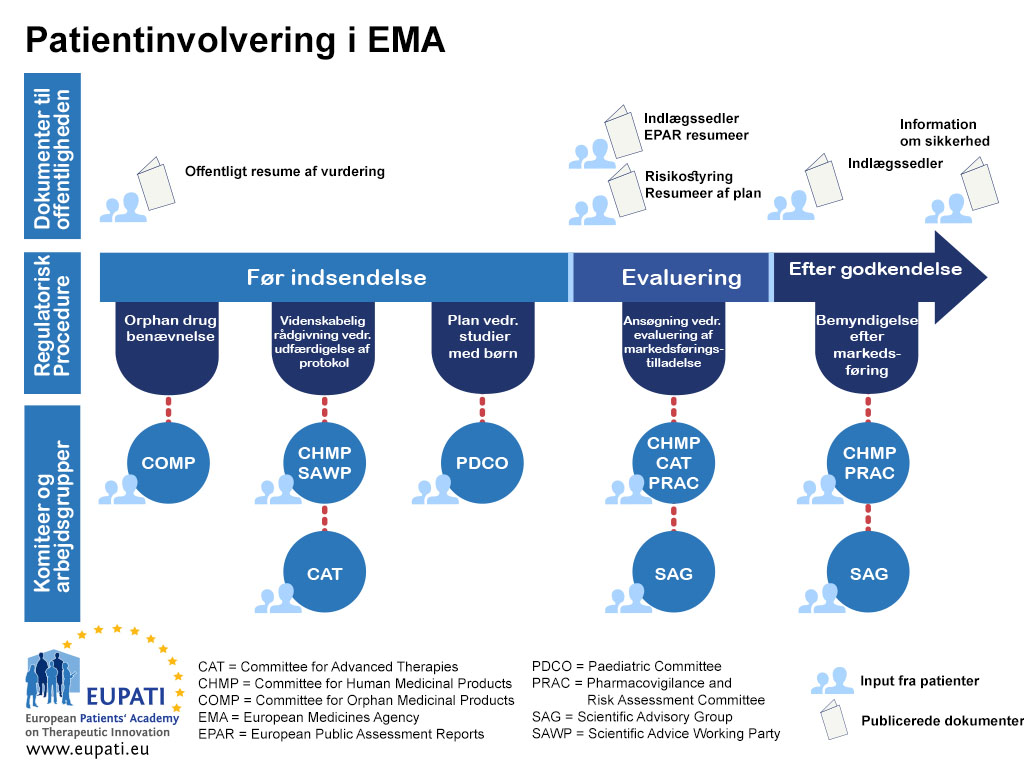
Patientinddragelse i EMA’s regulatoriske udvalg
Introduktion
Denne artikel fokuserer på lovgivningen i Den Europæiske Union (EU) og retningslinjerne fra Det Europæiske Lægemiddelagentur (EMA). Den omhandler ikke national lovgivning eller retningslinjer fra lande uden for EU. Patientforeningernes rolle er beskrevet på EMA-niveau.
Det Europæiske Lægemiddelagentur (EMA)
Det Europæiske Lægemiddelagentur (EMA) er ansvarlig for den videnskabelige vurdering af human- og veterinærmedicinske lægemidler i Den Europæiske Union.
EMA har været i dialog med de europæiske patienter og forbrugere, siden det blev oprettet i 1995. Som brugere af de lægemidler, EMA vurderer, er patienterne vigtige interessenter i EMA’s arbejde, og de har en specifik viden og ekspertise.
Patienter og forbrugere inddrages i mange af EMA’s aktiviteter, lige fra gennemgang af information, som EMA har udarbejdet om lægemidler, til inddragelse i udarbejdelsen af retningslinjer, deltagelse i videnskabelige rådgivende grupper og medlemskab af EMA’s videnskabelige udvalg.
Patientinddragelse i EMA’s regulatoriske udvalg
Hidtil har fællesskabslovgivningens gennemførelse resulteret i, at patienterne er medlemmer af fire af EMA’s videnskabelige udvalg: Udvalget for Lægemidler til Sjældne Sygdomme (COMP), Det Pædiatriske Udvalg (PDCO), Udvalget for Avancerede Terapier (CAT) og Udvalget for Risikovurdering inden for Lægemiddelovervågning (PRAC). Patienterne er også repræsenteret i EMA’s bestyrelse.
Udvalget for Lægemidler til Sjældne Sygdomme (COMP)
COMP har siden sit første møde i april 2000 haft tre medlemmer, som repræsenterer patientforeningerne, og som udpeges af Europa-Kommissionen for en periode på tre år med mulighed for forlængelse.
Det Pædiatriske Udvalg (PDCO)
PDCO har siden september 2008 haft tre medlemmer og tre suppleanter, som repræsenterer patientforeningerne, og som udpeges af Europa-Kommissionen for en periode på tre år med mulighed for forlængelse.
Udvalget for Avancerede Terapier (CAT)
CAT har siden januar 2009 haft to medlemmer og to suppleanter, som repræsenterer patientforeningerne, og som udpeges af Europa-Kommissionen for en periode på tre år med mulighed for forlængelse.
Udvalget for Risikovurdering inden for Lægemiddelovervågning (PRAC)
PRAC har siden juli 2012 haft et medlem og en suppleant, som repræsenterer patientforeningerne, og som udpeges af Europa-Kommissionen for en periode på tre år med mulighed for forlængelse.
Patienternes rolle og værdi som medlemmer af de videnskabelige udvalg
Patienter, som er medlemmer af EMA's videnskabelige udvalg, handler på samme måde som alle andre medlemmer. Erfaringen har vist, at patienterne meget ofte bidrager videnskabeligt til drøftelserne. Merværdien ved at have patienter og forbrugere med i de videnskabelige udvalg er et unikt og kritisk input, som er baseret på deres sygdomserfaringer fra det virkelige liv og deres erfaringer med det nuværende behandlingsmiljø. Patientens indsats bør fokusere på at sikre, at dette unikke perspektiv gør sig gældende i alle udvalgets aktiviteter og resultater.
Alle udvalgsmedlemmer:
- Deltager i overensstemmelse med udvalgets forretningsorden og fastlagte opgaver
- Har tavshedspligt, erklærer enhver interessekonflikt og overholder EMA's adfærdskodeks
- Deltager i udvalgets beslutninger og har lige stor stemmevægt. Suppleanter kan deltage i alle udvalgsmøder og bidrage til arbejdet og drøftelserne i udvalgene med lige rettigheder.
Flere ressourcer
- European Medicines Agency (2014). EMA/652164/2014 Annex II: EMA activities where patients* and consumers are involved. Retrieved 31 August, 2015 from http://www.ema.europa.eu/docs/en_GB/document_library/Other/2014/12/WC500179568.pdf
- European Medicines Agency (2014). EMA/24913/2005 – rev. 2. Criteria to be fulfilled by patients’ and consumers’ organisations involved in European Medicines Agency (EMA) activities. Retrieved 4 September, 2015 from http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
- European Medicines Agency (2013). EMA/272219/2013 Sixth annual report on the interaction with patient’s’ and consumers’ organisations (2012). Retrieved 4 September, 2015 from http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
Bilag
A2-5.08.1-v1.3