Vejledning i patientinddragelse i regulatoriske processer
Overordnede principper for patientinddragelse i hele processen med forskning og udvikling af lægemidler
Det Europæiske Patientakademi (EUPATI) er et fælles europæisk initiativ vedrørende innovative lægemidler (IMI) og omfatter 33 organisationer med partnere fra patientforeninger, universiteter, nonprofit organisationer og medicinalvirksomheder. I hele EUPATI henviser begrebet “patient” til alle aldersgrupper og alle sygdomme. EUPATI fokuserer ikke på sygdomsspecifikke spørgsmål eller behandlinger, men på processen for udvikling af lægemidler generelt. Indikationsspecifikke oplysninger og aldersspecifikke eller specifikke lægemiddelbehandlinger er uden for EUPATI og ligger i stedet hos det sundhedsfaglige personale og hos patientforeningerne. Du kan finde flere oplysninger på eupati.eu/.
Langt størstedelen af de eksperter, der beskæftiger sig med udvikling og evaluering af lægemidler, er forskere, der arbejder både i den private og den offentlige sektor. Der er et stadig større behov for at trække på patienternes viden og erfaringer for at forstå, hvad det vil sige at leve med en specifik sygdom, både hvad angår pleje og den daglige brug af medicin. Dette input hjælper med at forbedre forskning, udvikling og evaluering af nye effektive lægemidler.
Et struktureret samarbejde mellem patienter i alle aldersgrupper og med alle slags diagnoser, deres repræsentanter og andre interessenter er nødvendigt og muliggør en informationsudveksling og konstruktiv dialog på nationalt og europæisk plan, hvor medicinbrugernes synspunkter kan og bør tages i betragtning. Det er vigtigt at tage højde for, at både sundhedssystemerne, medicinsk praksis og lovgivningen kan være forskellige.
Vi anbefaler et tæt samarbejde og partnerskab mellem de forskellige interessenter, herunder sundhedspersonaleorganisationer, kontraktforskningsorganisationer, patientforeninger og forbrugersammenslutninger*, den akademiske verden, videnskabelige og akademiske miljøer, lægemiddelmyndigheder, organer til medicinsk teknologivurdering (MTV) og medicinalindustrien. De hidtidige erfaringer viser, at inddragelsen af patienter har ført til øget gennemsigtighed, tillid og gensidig respekt mellem dem og de andre interessenter.
Det er anerkendt, at patienternes bidrag til forskning, udvikling og evaluering af lægemidler beriger kvaliteten af evidens og den tilgængelige viden.[1]
De eksisterende kodekser for patientinddragelse med forskellige interessenter dækker ikke hele området for forskning og udvikling (R&D) fuldt ud. EUPATI’s vejledninger tager sigte på at støtte brugen af patientinddragelse i hele processen med forskning og udvikling af lægemidler.
Disse vejledninger er ikke tænkt som konkrete regler og vil ikke give detaljeret anvisning trin for trin.
EUPATI har udarbejdet disse vejledninger til alle interessenter, der ønsker et samarbejde med patienterne om forskning og udvikling af lægemidler (R&D). Brugerne kan afvige fra denne vejledning alt efter specifikke forhold, national lovgivning eller særlige behov i forbindelse med det konkrete samarbejde. Denne vejledning bør tilpasses til de individuelle krav ud fra den bedste professionelle vurdering.
Der er fire separate vejledninger, som dækker patientinddragelse i:
- Forskning og udvikling af lægemidler udført af medicinalindustrien
- Etiske komitéer
- Lægemiddelmyndigheder
- Medicinsk teknologivurdering (MTV).
Hver vejledning indeholder forslag til områder, hvor der i øjeblikket er mulighed for patientinddragelse. Denne vejledning skal gennemgås og revideres med jævne mellemrum, så den afspejler udviklingen.
Denne vejledning dækker patientinddragelse på det regulatoriske myndighedsområde og tager udgangspunkt i dokumentet “Framework for interaction between the European Medicines Agency and patients and consumers and their organisations”.
I vejledningen anerkendes følgende værdier, som der arbejdes hen imod gennem indførelsen af de foreslåede praksisser (afsnit 7). Værdierne er:
| Relevans | Patienterne har viden, perspektiver og erfaringer, som er unikke, og som giver et væsentligt bidrag til vigtige aspekter af de regulatoriske aktiviteter. |
| Rimelighed | Patienterne har de samme rettigheder til at bidrage til de regulatoriske aktiviteter som andre interessenter, og de har adgang til viden og erfaringer, som muliggør en effektiv inddragelse. |
| Retfærdighed | Patientinddragelse i regulatoriske aktiviteter bidrager til retfærdighed ved at forsøge at forstå de forskellige behov hos patienter med særlige helbredsproblemer og afveje dem i forhold til de strenge krav i lovgivningen og retningslinjerne for lægemidler. |
| Legitimitet | Patientinddragelse gør det lettere for dem, der berøres af lægemiddelmyndighedernes beslutninger, at deltage i regulatoriske aktiviteter og dermed bidrage til gennemsigtighed, ansvarlighed og troværdighed i beslutningstagningsprocessen. |
| Kapacitetsopbygning | Processerne for patientinddragelse tager hensyn til hindringerne for at inddrage patienterne i regulatoriske aktiviteter og udvikler patienternes og lægemiddelmyndighedernes samarbejde. |
Alle vejledninger, der udarbejdes efterfølgende, skal tilpasses til den eksisterende nationale lovgivning, som det er nævnt i de fire EUPATI-vejledningsdokumenter.
Ansvarsfraskrivelse
EUPATI har udarbejdet denne vejledning til alle interessenter, der ønsker et samarbejde med patienterne om forskning og udvikling af lægemidler (R&D) i hele lægemidlernes R&D-livscyklus.
Disse vejledninger er ikke tænkt som konkrete regler og vil ikke give detaljeret anvisning trin for trin. Denne vejledning skal bruges i overensstemmelse med specifikke forhold, national lovgivning eller særlige behov i forbindelse med det enkelte samarbejde. Denne vejledning bør tilpasses til de individuelle krav ud fra den bedste professionelle vurdering.
Såfremt denne vejledning indeholder rådgivning om juridiske spørgsmål, skal denne rådgivning ikke ses som en endelig juridisk fortolkning, og den træder ikke i stedet for formel juridisk rådgivning. Såfremt formel rådgivning er nødvendig, skal de pågældende interessenter konsultere deres respektive juridiske afdelinger, hvis sådanne forefindes, eller søge juridisk rådgivning fra kompetente kilder.
EUPATI er under ingen omstændigheder ansvarlig for nogen udfald af nogen som helst karakter som følge af denne vejlednings anvendelse.
EUPATI-projektet har modtaget støtte fra IMI (fællesforetagendet for initiativet om innovative lægemidler) under tilskudsaftale nr. 115334. Disse ressourcer består af økonomiske bidrag fra Den Europæiske Unions syvende rammeprogram (RP7/2007-2013) og EFPIA-virksomhederne.
Omfang
Denne europæiske vejledning omhandler samarbejdet mellem patienterne og lægemiddelmyndighederne om lægemidler til mennesker. “Patienter” kan være enkelte patienter eller deres omsorgspersoner, eller det kan være repræsentanter for patientforeninger med relevant ekspertise (afsnit 4). Lægemiddelmyndighederne omfatter både de nationale lægemiddelmyndigheder og Det Europæiske Lægemiddelagentur (EMA) Patientforeninger er nonprofitorganisationer, der har interesse i patientbehandling og -pleje, og hvor patienterne udgør flertallet af ledelsesorganernes medlemmer.
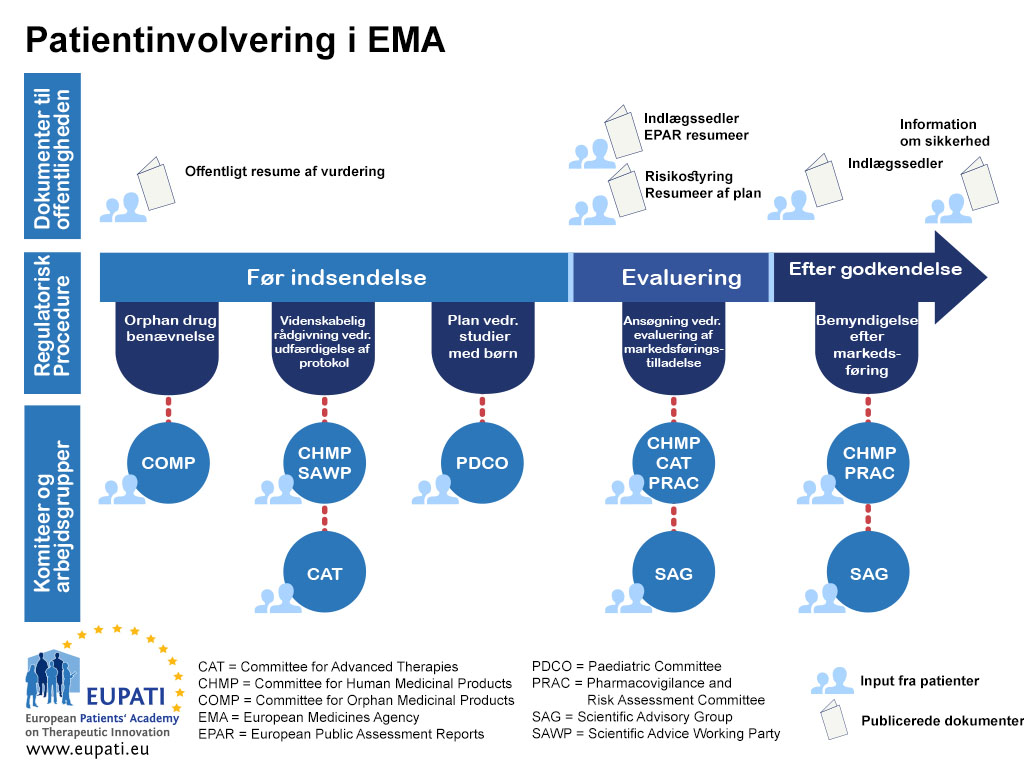
Vejledningen har fokus på inddragelse og omhandler ikke den videnskabelige indsamling af patientperspektiver (dvs. kvantitativ og kvalitativ systematisk forskning i de psykosociale konsekvenser af sygdomme og behandlinger). Figur 1 viser, hvor patienter aktuelt kan blive inddraget i lægemidlets hele R&D-livscyklus. Dette er dog ikke ment som en begrænsning af inddragelsen, og mulighederne kan ændre sig og blive større med tiden.
Definition af "patient"
Begrebet "patient" anvendes ofte som et generelt, upræcist begreb, som ikke afspejler de forskellige typer input og erfaring, der kræves af patienterne, patientrepræsentanterne og patientforeningerne i forskellige samarbejdsprocesser.
For at skabe klarhed omkring terminologien for de potentielle roller i patientinddragelsen, der præsenteres i dette og i andre EUPATI-vejledningsdokumenter, bruger vi begrebet "patient", som dækker følgende definitioner:
- "Enkelte patienter" er personer, der har personlig erfaring med at leve med en sygdom. De kan evt. have teknisk viden om R&D eller de regulatoriske processer, men deres vigtigste rolle er at bidrage med deres subjektive sygdoms- og behandlingserfaring.
- "Omsorgspersoner" er personer, der støtter de enkelte patienter, såsom familiemedlemmer eller betalte eller frivillige hjælpere.
- "Patientrepræsentanter" er personer, som har viden om og erfaring med at støtte en større gruppe patienter, der lever med en specifik sygdom. De kan evt. være tilknyttet en patientforening.
- "Patientforeningsrepræsentanter" er personer, der har mandat til at repræsentere og udtrykke de kollektive synspunkter hos en patientforening om et specifikt spørgsmål eller sygdomsområde.
- "Patienteksperter" har, ud over den sygdomsspecifikke ekspertise, opnået faglig viden om R&D og/eller regulatoriske forhold gennem uddannelse eller erfaring. Det kan f.eks. være EUPATI-eksperter, som er uddannet af EUPATI i alle aspekter af R&D af lægemidler.
Der kan være visse forbehold med hensyn til inddragelsen af enkelte patienter i et samarbejde med interessenterne, fordi deres input vil være subjektivt og modtageligt for kritik. EUPATI opfordrer dog, ligesom lægemiddelmyndighederne, til en retfærdig tilgang, hvor man ikke udelukker de enkelte patienters inddragelse. Det bør overlades til den eller de organisation(er)s skøn, der indleder samarbejdet, at vælge den mest passende patientrepræsentation, dvs. hvilken type patient der egner sig til hvilken aktivitet (se afsnit 7). Hvis en enkelt patient inddrages, foreslås det, at den relevante patientforening, hvis en sådan forefindes, informeres og/eller høres for at give støtte og/eller rådgivning.
Den inddragede persons type input og mandat bør vedtages i enhver samarbejdsproces inden inddragelsen.
Rationale for vejledningen
Udstrækningen af patientinddragelse i regulatoriske spørgsmål varierer betydeligt mellem landene og regionerne i Europa.
EMA har haft et samarbejde med sine interessenter siden oprettelsen i 1995. Disse forbindelser til interessenterne har udviklet sig med tiden, og samarbejdets type og grad varierer alt efter den pågældende interessentgruppe og EMA-aktivitetens type. I EMA's bestyrelse og visse videnskabelige udvalg er patienter og forbrugere inddraget som medlemmer.
Den fordel ved interessentinddragelse, som EMA har oplevet, har resulteret i, at adskillige nationale lægemiddelmyndigheder ligeledes har indført en ramme for patientinddragelse på nationalt plan. De fleste nationale lægemiddelmyndigheder trækker på EMA's erfaringer. EMA's inddragelse af patienter er fastlagt i den europæiske lovgivning [2]. EMA, EMA's bestyrelse og de forskellige videnskabelige udvalg er ansvarlige for at udvikle forbindelserne mellem EMA og agenturets interessenter.
Den europæiske lovgivning fastlægger:
- Et direkte samarbejde mellem EMA, patientforeningerne og forbrugerorganisationerne via EMA's patient- og forbrugerarbejdsgruppe (PCWP).
- Rammerne for at give klar og nyttig information til disse foreninger og organisationer.
- Specifikke former for samarbejde, f.eks. patienternes medlemskab af EMA's bestyrelse, Udvalget for Lægemidler til Sjældne Sygdomme (COMP), Det Pædiatriske Udvalg (PDCO), Udvalget for Avancerede Terapier (CAT), procedurerne for videnskabelig rådgivning/protokolassistance inden for Arbejdsgruppen vedrørende Videnskabelig Rådgivning (SAWP) og Udvalget for Risikovurdering inden for Lægemiddelovervågning (PRAC).
- Herudover har EMA indført metoder til at få input fra patienterne gennem direkte høring.
De hidtidige erfaringer viser, at patienternes deltagelse i EMA's aktiviteter har ført til øget gennemsigtighed og tillid til de regulatoriske processer og gensidig respekt mellem lægemiddelmyndighederne, patientgruppen og forbrugerne. Erfaringerne bekræfter, at det er vigtigt for EMA at fortsætte med at støtte og lette patienternes bidrag til EMA's arbejde.
Nogle tilsvarende bestemmelser findes muligvis ikke på nationalt plan. Da der ikke er nogen lovgivningsbestemmelser, udvikler de nationale kompetente myndigheder deres rammer ud fra EMA's erfaringer, eller også udvikler de deres helt egne rammer: I sådanne rammer skal der bl.a. tages højde for følgende hovedelementer:
- En definition af patienternes rolle i samarbejdet
- Medtagelse af forslag om at inddrage patienterne i specifikke institutionelle processer
- Udvikling af et uddannelsesprogram
- Overvejelse af en ordning for ekspertkompensation, der gælder for alle interessenter
- En kontinuerlig evaluering af samarbejdet med henblik på yderligere forbedringer og et samarbejde mellem agenturerne og patienterne for at fastlægge og standardisere metoder og praksisser.
Enhver samarbejdsramme skal gennemgås regelmæssigt.
Formål med patientinddragelse i myndighedsregulering af lægemidler
Strømlining af samarbejdet med patienterne og fokus på de områder, hvor der kan forventes gensidige fordele, er to underliggende principper, der skal tages i betragtning ved indførelsen af en samarbejdsramme.
Målet bør være en yderligere opbygning af gennemsigtighed og tillid sammen med patientsamfundene gennem deres aktive engagement (deltagelse-høring-information). For at opfylde dette mål er der nogle specifikke målsætninger, som skal nås, f.eks. følgende:
- Lægemiddelmyndighederne skal hjælpes med at få adgang til sygdomserfaringer fra det virkelige liv og håndteringen af disse og med at indhente information om den nuværende brug af lægemidler. Dette vil bidrage til forståelsen af den værdi, som patienterne tillægger den videnskabelige evidens, der fremlægges under evalueringsprocessen, for at der kan tages en beslutning ud fra fordele og risici.
- Det skal sikres, at patienterne og deres repræsentative foreninger bliver lyttet til, hørt og inddraget i fastlæggelsen af politikker og planer.
- Patientforeningernes forståelse af lægemiddelmyndighedernes mandat og rolle, når det gælder udvikling, evaluering, godkendelse, overvågning og fremskaffelse af information om lægemidler, skal styrkes.
- Kommunikationsværktøjerne skal optimeres (med hensyn til indhold og levering) for at lette og fremme informationsflowet til patientforeningernes grupper ( f.eks. for at nå ud til de enkelte patienter) med henblik på at støtte deres rolle i en sikker og rationel brug af lægemidler.
- Det skal gøres lettere at have patienter til at deltage i benefit/risk-vurderinger og tilknyttede aktiviteter, at registrere patienternes værdier og præferencer og at få information om den nuværende brug af lægemidler og behandlingen. Dette gælder for hele livscyklussen for lægemidlernes udvikling, lige fra den tidlige udvikling til evalueringen og overvågningen efter markedsføring.
At nå disse mål vil kræve et tæt samarbejde mellem lægemiddelmyndighederne, de nationale sundhedsministerier og andre relevante interessenter samt en aktiv deltagelse og et godt samarbejde med patienter, sundhedspersonale og deres repræsentative foreninger.
Foreslåede arbejdspraksisser (tilpasset efter EMA's ramme for samarbejdet)
På baggrund af EMA's erfaringer på europæisk plan kan patienterne deltage i lægemiddelmyndighedens aktiviteter som:
- Medlemmer (og suppleanter) i nogle af lægemiddelmyndighedens (videnskabelige) udvalg eller arbejdsgrupper og, hvad EMA angår, i EMA's bestyrelse (formelt udpeget af EU-institutionerne).
- Individuelle eksperter.
- Repræsentanter for en specifik patientforening, som skal høres og deltage i drøftelserne for at give udtryk for foreningens synspunkter om et specifikt spørgsmål.
- Lejlighedsvise observatører i visse aspekter af EMA's eller lægemiddelmyndighedens arbejde.
Lægemiddelmyndighederne skal opstille udvælgelseskriterier.
Når patienterne deltager i lægemiddelmyndighedernes aktiviteter som enkeltpersoner og ikke som repræsentanter for deres patientforening, skal de deklarere eventuelle interesser og overholde lægemiddelmyndighedens adfærdskodeks ligesom alle andre eksperter. Desuden skal de patientforeninger, som samarbejder med lægemiddelmyndigheden, være fuldstændigt åbne omkring deres aktiviteter og finansieringskilder.
For at nå de mål, der er identificeret i afsnit 4, bør følgende seks elementer betragtes som kritiske:
- Et netværk af patientforeninger (evt. i samarbejde med andre lægemiddelmyndigheder)Netværket af patientforeninger gør det muligt for lægemiddelmyndigheden at skabe et konsekvent og målrettet samarbejde med en bred gruppe af foreninger, der har forskellig ekspertise og forskellige interesser. Der bør anvendes nogle udvælgelseskriterier. Sådanne kriterier skal sikre, at lægemiddelmyndigheden skaber kontakt til de patientforeninger, der bedst repræsenterer patienterne på en gennemsigtig måde. Kriterierne bør harmoniseres inden for netværket.
- Et forum til udveksling af synspunkter med patientforeninger, der er oprettet inden for lægemiddelmyndighedens rammerDer er tale om en platform for dialog og udveksling af synspunkter med patientforeningerne om relevante spørgsmål, der vedrører lægemidler til mennesker og relevant, medicinsk udstyr. Via denne platform vil lægemiddelmyndigheden informere patienterne om forskellige myndighedsinitiativer og modtage feedback og bidrag fra patienterne. Den omfatter en afbalanceret repræsentation af de forskellige typer patienter såvel som foreninger, der repræsenterer særlige og sårbare befolkningsgrupper, som ikke er så godt repræsenteret inden for udvikling af lægemidler, såsom ældre mennesker og kvinder. Det skal være et forum, som gør det muligt at identificere yderligere mangler og prioriteringer i det overordnede samarbejde.
- En gruppe af individuelle patienter, der fungerer som eksperter i deres sygdom og dens behandling for at fremme patienternes inddragelse i evaluering af lægemidler og informationEkspertgruppens oprettelse vil give lægemiddelmyndigheden mulighed for hurtigt og effektivt at identificere de patienter, der kan inddrages i produktrelaterede aktiviteter, gennemgang af produktinformation og kommunikationsmateriale.
- Et samarbejde særligt inden for kommunikationsområdet Dette vil give et værdifuldt bidrag til støtte for de eksisterende systemer til udbredelse af information til offentligheden. Endvidere vil samarbejdet på dette område gøre det lettere for patienterne at få valideret og opdateret information om lægemidlers fordele og risici og bidrage til udarbejdelsen og udbredelsen af klare budskaber til offentligheden om sikker og rationel brug af lægemidler. Alt informationsmateriale til patienter bør gennemgås af patientrepræsentanter for at forbedre læsbarheden og gøre sproget og indholdet mere hensigtsmæssigt.
- Et handlingsprogram for kapacitetsopbygning, hvor der fokuseres på uddannelse og på at øge kendskabet til det regulatoriske myndighedssystem Hvis deres bidrag skal være meningsfulde, skal patienterne forstå lægemiddelmyndighedens mandat og den rolle, som patienten forventes at spille i evalueringsprocessen. Der bør være et uddannelsesprogram. Nogle patientforeninger eller andre samarbejdsprojekter har udarbejdet deres eget uddannelsesmateriale for at give patienterne mulighed for at spille en relevant repræsentantrolle.
- Finansiel støtte Der bør ydes finansiel støtte til patienter, som bidrager til lægemiddelmyndighedens aktiviteter. Det ville være en anerkendelse af det arbejde, de gør, og fremme deres uafhængighed. Patienterne bør anerkendes som eksperter og behandles efter de samme standarder som alle andre eksperter, også når det gælder kompensation. Nogle gange kan patienterne have brug for yderligere assistance for at sikre, at de er i stand til at deltage.
Definition af samarbejdet
Før hver samarbejdssituation skal parterne aftale følgende (hvis relevant):
- Formålet med den aktivitet, som involverer patienterne og/eller områder af fælles interesse, med henblik på at etablere et aftalt, struktureret samarbejde, der giver alle parter den nødvendige beskyttelse med hensyn til uafhængighed, privatlivets fred, fortrolighed og forventninger.
- Typen af input og mandat for den involverede person
- Hvordan samarbejdet fungerer, f.eks. mødehyppighed, grundregler, konfliktløsning, kompensation og evaluering.
- Samarbejdsmetoden (møder, telefonsamtaler osv.) skal drøftes og aftales mellem parterne med, og hvor nemt det er for patienterne/patientforeningerne har førsteprioritet. Hvis samarbejdet kræver personlige møder eller tilrettelæggelse og afholdelse af arrangementer, skal disse følge de eksisterende adfærdskodekser, hvad angår et passende sted/placering og niveauet af forplejning.
- Når der afholdes arrangementer, skal evnen til at deltage for de patienter, man ønsker skal deltage, tages i betragtning, og der skal træffes passende foranstaltninger for at sikre tilgængelighed, rejseassistance og adgang til arrangementet.
- Den ønskede patientforening og patientpartnerorganisation, som skal fremme et langvarigt samarbejde med sikkerhed for uafhængighed.
- Profilen på den type patient(er) eller patientrepræsentant(er), der skal inddrages, og deres antal.
- Hvordan outputtet fra aktiviteterne skal bruges.
- Hvordan og hvornår den eller de inddragede patient(er) vil blive informeret om resultaterne.
- Kontraktvilkår og -betingelser, herunder samtykke og fortrolighed samt en aftale om selve samarbejdet (mødetype, hyppighed og kompensation).
- Andre elementer alt efter den specifikke aktivitet.
Patientidentifikation/samarbejde
Der er mange måder at identificere patienter på, som skal inddrages i et samarbejde. De vigtigste måder er følgende:
- eksisterende patientforeninger
- EUPATI eller et lignende projekt
- annoncering efter patientdeltagelse
- offentligt udbud
- eksisterende forbindelser med sundhedsudbydere, hospitaler og forskere eller andre organer
- uopfordrede anmodninger, som tidligere er modtaget fra interesserede parter
- eksisterende rådgivende komitéer/grupper (f.eks. EMA's patient- og forbrugerarbejdsgruppe eller EFPIA's tænketank)
- tredjepartsorganer
Udvælgelseskriterier
Patientforeninger
For at øge gennemsigtigheden i patientinddragelsen bør myndighederne og patientforeningerne planlægge at offentliggøre deres samarbejdsaktiviteter hvert år. Enkelte patienters navne kan offentliggøres, når personen deltager i en generel rådgivende gruppe, men navnene må ikke offentliggøres i andre tilfælde.
Patientforeningerne skal være engageret i at deltage aktivt i samarbejdet med en lægemiddelmyndighed.
Patientforeningerne skal være etableret i en medlemsstat i Den Europæiske Union (EU) eller Det Europæiske Økonomiske Samarbejdsområde (EØS) og skal opfylde følgende kriterier:
| Legitimitet: | Foreningen skal have registreret sine vedtægter i en af EU's/EØS' medlemsstater. Hvis det er en international forening, som ikke er registreret i en af EU's/EØS' medlemsstater, skal der fremlægges yderligere information til bevis for foreningens EU-fokus og EU-aktiviteter. |
| Mission/mål: | Foreningen eller den individuelle patientekspert skal have en klart defineret mission eller klart definerede mål og skal give samtykke til at offentliggøre den/dem på lægemiddelmyndighedens websted. |
| Aktiviteter: | Foreningen skal som led i sine aktiviteter have en specifik interesse for lægemidler (og medicinsk udstyr, hvis relevant), og dette skal dokumenteres (f.eks. ved hjælp af en rapport, der er offentliggjort på foreningens eller den individuelle persons websted). |
| Repræsentation: | Foreningen skal være repræsentativ for patienterne i hele EU/EØS eller på det relevante nationale plan. Foreninger, der allerede er registreret på Fællesskabsplan, f.eks. i EU's sundhedsforum eller Europarådet, anses for at have en tilstrækkelig repræsentation af patienterne eller inddragelse i regulatoriske aktiviteter vedrørende lægemidler.
Såfremt der mangler europæiske foreninger for en specifik sygdom eller et specifikt behandlingsområde, kan det overvejes at inddrage nationale foreninger, selv om europæiske foreninger vil blive foretrukket. Internationale foreninger kan også tages i betragtning ved udvælgelsen, når blot de har et europæisk fokus og en europæisk repræsentation, herunder kontor(er) baseret i EU/EØS. |
| Opbygning: | Foreningen skal have ledelsesorganer, som er valgt af dens medlemmer, der består af patienter og deres omsorgspersoner eller deres valgte repræsentanter. |
| Ansvarlighed og høringsmetoder: | Foreningens udtalelser og holdninger skal afspejle synspunkterne og holdningerne hos foreningens medlemmer, og der skal være indført passende procedurer til høring af disse medlemmer. Foreningen skal navnlig sikre, at der er et passende informationsflow, som muliggør en dialog begge veje: fra og til dens medlemmer. |
| Gennemsigtighed: | Foreningen skal informere lægemiddelmyndigheden om sine finansieringskilder, både de offentlige og de private, ved at angive navnet på organerne og deres individuelle finansielle bidrag, både i absolutte tal og i procent af foreningens budget. Enhver forbindelse med sponsorer fra industrien skal være klar og gennemskuelig. Disse oplysninger skal gives til agenturet en gang om året.
Såfremt der er tale om paraplyforeninger, skal listen over medlemsforeninger gøres tilgængelige for myndigheden. Foreningen skal offentliggøre de registrerede vedtægter på sit websted sammen med finansiel information, herunder både offentlige og private finansieringskilder, og information om sine aktiviteter. Foreningen skal følge en adfærdskodeks/politik, der regulerer dens forbindelser til og uafhængighed af sponsorerne. Lægemiddelmyndigheden vil evaluere den finansielle information i henhold til et gennemsigtigt regelsæt, der er defineret på forhånd. |
Kompensation
Man skal være opmærksom på, at patienter, der er involveret i aktiviteter, ofte gør dette frivilligt enten som enkeltperson eller som medlem af en patientforening. Derfor bør følgende overvejes:
- At kompensere dem for den samlede tid, de har brugt, og deres udgifter.
- At enhver kompensation, der tilbydes, skal være rimelig og passende i forhold til engagementet. Ideelt set skal rejseudgifterne betales direkte af den partner, der står for organisationen, i stedet for at blive refunderet.
- At patientforeningernes omkostninger bør dækkes, når de identificerer eller støtter patienter, som skal inddrages i aktiviteterne (dvs. støttegrupper, uddannelse og forberedelse).
- At hjælpe med at organisere den logistiske del af patientdeltagelsen, herunder rejser og/eller indkvartering.
Kompensation omfatter også indirekte naturalieydelser (såsom gratis tjenester fra en patientforenings side) eller enhver anden form for ikkefinansielle naturalieydelser, som patienten/patientforeningen modtager (såsom kurser og oprettelse af websteder).
Skriftlig aftale
En skriftlig aftale skal som minimum indeholde en klar definition af følgende: en beskrivelse af aktiviteten og dens målsætninger, samarbejdets karakter under aktiviteten, samtykke (hvis relevant), frigivelse, fortrolighed, kompensation, datafortrolighed, overholdelse, erklæring om interessekonflikt og tidsfrister. Samarbejdet kan kun finde sted på grundlag af en skriftlig aftale, der som minimum fastsætter de grundlæggende elementer i samarbejdet (f.eks. reglerne for inddragelsen, overholdelse, intellektuel ejendomsret og finansielle godtgørelser). Det skal sikres, at skriftlige aftaler er klare, og at de ikke begrænser en hensigtsmæssig vidensdeling.
Gennemførelse og overvågning
En ramme for patientinddragelsen kan indføres trin for trin og/eller ved at følge en pilotfase, hvis dette er hensigtsmæssigt. Efter en fuldstændig gennemførelse, hvor patienterne er inddraget i både generelle og produktspecifikke spørgsmål, og der er etableret en gruppe af patientforeninger og patienter som individuelle eksperter og til samarbejdsfora, bør der udarbejdes en offentlig årlig rapport om samarbejdet, som omfatter:
- en analyse af indikatorerne (som skal fastlægges for det pågældende type samarbejde), hvor samarbejdets nytte vurderes
- feedback, der er modtaget fra patienterne og deres foreninger gennem målrettede undersøgelser
- feedback, der er modtaget fra selve lægemiddelmyndigheden
- en oversigt over de aktiviteter, hvor patientforeninger og patienter som individuelle eksperter er blevet inddraget
- en foreslået vej fremad, der bør anbefales, herunder en strategi for kommende patientsamarbejde.
Bilag 1 – Oversigt over patientinddragelse i regulatoriske processer – EMA's eksempel
#mla_gallery-2 { margin: auto; width: 100%; } #mla_gallery-2 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-2 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-2 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
Bilag 2 – Gennemgåede adfærdskodekser
En række anerkendte adfærdskodekser kan udgøre et vigtigt grundlag for denne vejledning.
- The ECAB Protocol (description of and working procedures of ECAB (European Community Advisory Board, scientific working group at EATG, established 1997))
- Mandate, objectives and rules of procedure for the European Medicines Agency Human Scientific Committees’ Working Party with Patients' and Consumers' Organisations (PCWP) (30 May 2013)
- Minutes of EMA Human Scientific Committees’ Working Party with Patients’ and Consumers’ Organisations (PCWP) meeting with all eligible organisations (31 January 2014)
- 10 December 2009 EMA Reflection Paper on the Further Involvement of Patients and Consumers in the Agency’s Activities
- EMA leaflet on working with patients and consumers (updated 22/4/2015)
- EMA framework of interaction (revised 16 October 2014)
- Recommendations from ECAB meeting held in Bergen, Norway 1997EATG ECAB, “The impatient Patient - From Anger to Activism”A systematic review of the history, working models, relevance and perspectives of the European Community Advisory Board
- FDA Patient Representative Program
- FDA Patient-Focused Drug Development; The Voice of the Patient: A Series of Reports from FDA's Patient-Focused Drug Development Initiative
- FDA Patient-Focused Drug Development: Enhancing Benefit-Risk Assessment in Regulatory Decision-Making
- WMA Declaration of Helsinki - Ethical Principles for Medical Research Involving Human Subjects Retrieved 13 July, 2021, from https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/
Referencer
- Adapted from the EMA framework. European Medicines Agency (2014) EMA/637573/2014. http://www.ema.europa.eu/docs/en_GB/document_library/Other/2009/12/WC500018013.pdf. Last Accessed 21.11.2016.
- Regulation (EC) No 726/2004 http://ec.europa.eu/health/files/eudralex/vol-1/reg_2004_726/reg_2004_726_en.pdf. Last Accessed 21.11.2016.
*Forbrugerne er anerkendt som interessenter i sundhedsplejedialogen. I EUPATI's virke er der fokus på patienterne frem for forbrugerne, hvilket afspejles i uddannelsesmaterialet og vejledningsdokumenterne.