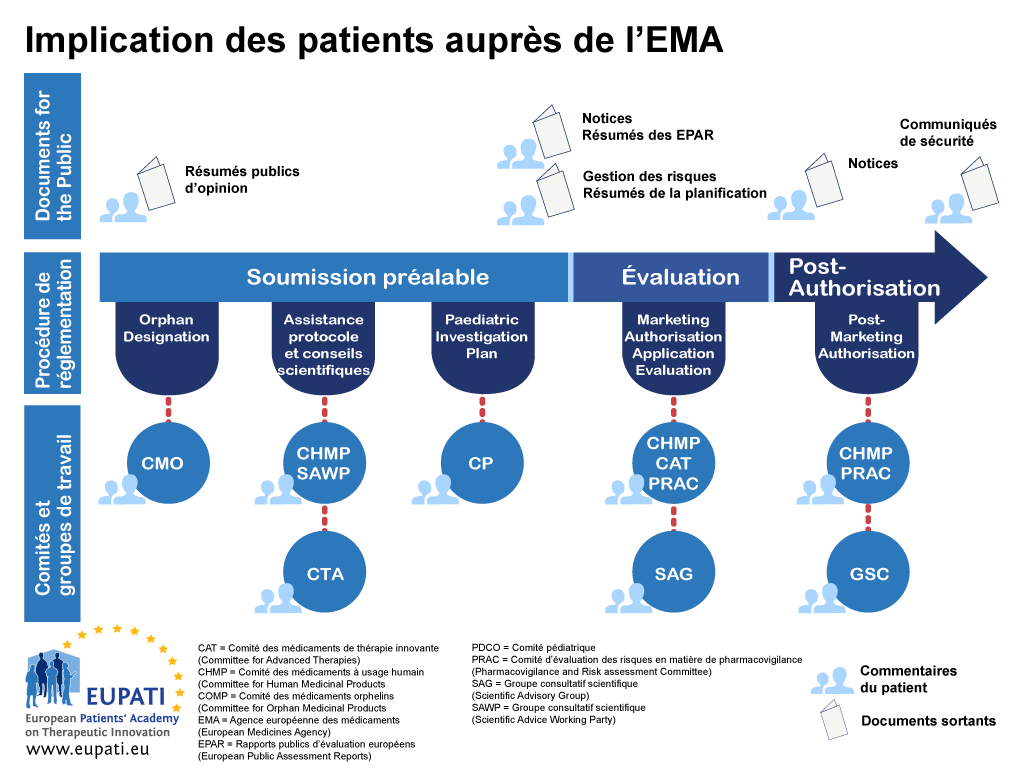
Participation des patients dans les comités réglementaires de l’EMA
Introduction
Cet article se concentre sur la réglementation de l’Union européenne (UE) et les directives de l’Agence européenne des médicaments (EMA). Il ne détaille pas la législation nationale ou les directives extérieures à l’UE. Les rôles des associations de patients sont décrits au niveau de l’EMA.
L’Agence européenne des médicaments (EMA)
L’Agence européenne des médicaments (EMA) est responsable de l’évaluation scientifique des médicaments à usage humain et vétérinaire dans l’Union européenne.
L’EMA a ouvert le dialogue avec les patients et les consommateurs européens depuis sa création en 1995. En tant qu’utilisateurs des médicaments évalués par l’EMA, les patients sont des acteurs clés du travail de l’EMA et disposent de connaissances et d’un savoir-faire spécifiques.
Les patients et les consommateurs participent à de nombreuses activités de l’EMA : analyse des informations préparées par l’EMA sur les médicaments, participation à la préparation des directives, aux groupes consultatifs scientifiques et adhésion aux comités scientifiques de l’EMA.
Participation des patients dans les comités réglementaires de l’EMA
À ce jour, la mise en œuvre de la législation communautaire a permis aux patients d’adhérer à quatre des comités scientifiques de l’EMA : le Comité des médicaments orphelins (COMP), le Comité pédiatrique (PDCO), le Comité des médicaments de thérapie innovante (CAT) et le Comité d’évaluation des risques en matière de pharmacovigilance (PRAC). Les patients sont également représentés au Comité de direction de l’EMA.
- Les patients peuvent s’engager de différentes façons auprès de l’EMA tout au long de la procédure réglementaire.
Comité des médicaments orphelins (COMP)
Depuis sa première réunion en avril 2000, le COMP comprend parmi ses membres trois représentants des associations de patients nommés pour une période renouvelable de trois ans par la Commission européenne.
Comité pédiatrique (PDCO)
Depuis septembre 2008, le PDCO comprend parmi ses membres trois représentants des associations de patients et leurs trois suppléants nommés par la Commission européenne pour une période renouvelable de trois ans.
Comité des médicaments de thérapie innovante (CAT)
Depuis janvier 2009, le CAT comprend parmi ses membres deux représentants des associations de patients et leurs deux suppléants nommés par la Commission européenne pour une période renouvelable de trois ans.
Comité d'évaluation des risques en matière de pharmacovigilance (PRAC)
Depuis juillet 2012, le PRAC comprend parmi ses membres un représentant des associations de patients et son suppléant nommés par la Commission européenne pour une période renouvelable de trois ans.
Le rôle et l'importance des patients en tant que membres des comités scientifiques
Les patients membres des comités scientifiques de l'EMA se comportent de la même façon que les autres membres. L'expérience a montré que les patients contribuent très souvent à alimenter le débat scientifique. La valeur ajoutée générée par la présence de patients et de consommateurs dans les comités scientifiques est un apport essentiel et unique issu de leur expérience concrète de la maladie et de son environnement thérapeutique. Les patients doivent veiller à préserver cette approche unique tout au long des activités et des résultats du comité.
Tous les membres du comité :
- Participent en accord avec les règles de procédures du comité et les tâches définies
- Préservent le confidentialité, déclarent tout conflit d'intérêt et se conforment au code de conduite de l'EMA
- Prennent part aux décisions du comité et disposent d'un droit de vote égal. Les suppléants ont tout autant le droit d'assister aux réunions des comités et de participer aux travaux et aux discussions de ces derniers.
Ressources complémentaires
- Agence européenne des médicaments (2014). EMA/652164/2014 Annex II : EMA activities where patients* and consumers are involved. Consulté le 31 août 2015 sur http://www.ema.europa.eu/docs/en_GB/document_library/Other/2014/12/WC500179568.pdf
- Agence européenne des médicaments (2014). EMA/24913/2005 – rev. 2. Criteria to be fulfilled by patients’ and consumers’ organisations involved in European Medicines Agency (EMA) activities. Consulté le 4 septembre 2015 sur http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
- Agence européenne des médicaments (2013). EMA/272219/2013 Sixth annual report on the interaction with patient’s’ and consumers’ organisations (2012). Consulté le 4 septembre 2015 sur http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
Annexes
A2-5.08.1-v1.3