Nowe podejście do badań klinicznych: Badania adaptacyjne
Wprowadzenie
W tradycyjnym paradygmacie dotyczącym projektowania badania klinicznego, każdy nowy sposób leczenia podlega ścisłemu procesowi rozwoju. Po udanych badaniach fazy I należy przeprowadzić badanie fazy II, aby wykazać wystarczającą skuteczność i bezpieczeństwo. Po wykazaniu odpowiedniej skuteczności i bezpieczeństwa badanego leku następuje faza III badań, w trakcie której badany lek jest porównywany z leczeniem standardowym (kontrola). Przeprowadzenie takich badań dla każdego indywidualnego sposobu leczenia wymaga długiego okresu czasu, dużej liczby pacjentów i znacznych zasobów finansowych. Ponadto, w tradycyjnym podejściu nie są dozwolone zmiany w trakcie badania.
Nowym podejściem projektowania badania klinicznego jest projektowanie adaptacyjne. Adaptacyjne badania kliniczne obejmują wstępnie zaplanowaną możliwość modyfikacji jednego lub więcej określonych aspektów procesu. Opiera się to zazwyczaj na analizie tymczasowych danych uczestników uzyskanych w trakcie badania.
Istnieje wiele powodów do korzystania z projektów adaptacyjnych (lub ścieżek adaptacyjnych) w badaniach klinicznych. W środowisku narażonym na wyzwania gospodarcze, badania adaptacyjne wydają się być atrakcyjne dla przemysłu farmaceutycznego, instytucji akademickich, lekarzy i pacjentów.
Badania adaptacyjne
Badania adaptacyjne są stosunkowo elastycznymi projektami badań klinicznych, pozwalającymi na modyfikacje w trakcie procesu w celu jego usprawnienia i optymalizacji. Analizy zgromadzonych danych badania wykonuje się w zaplanowanych wcześniej punktach czasowych badania; można je przeprowadzić w całkowicie zaślepiony lub odślepiony sposób; mogą obejmować lub nie uwzględniać formalnego testowania hipotez statystycznych. Ważnym jest, aby proces został tak zmodyfikowany, aby nie naruszyć ważności i integralności procesu.
Badania adaptacyjne mogą stanowić wyzwanie operacyjne ze względu na swoją złożoność, a proces dostosowania badania może przyczynić się do powstania błędu systematycznego. Błąd ten może być statystyczny lub operacyjny — na przykład, jeśli dostosowanie „sugeruje”, że wyniki badania wskazują na określony kierunek.
Projekt adaptacyjny może poprawić efektywność badania z punktu widzenia sponsora i uczestników badania. Jednakże, jeśli nie zostanie przeprowadzony prawidłowo, wówczas istnieje duże ryzyko, że takie badanie wygeneruje wyniki kliniczne, które są trudne do interpretacji i „przełożenia” na codzienną praktykę medyczną
Badania adaptacyjne w przypadku chorób rzadkich
Badania kliniczne dotyczące chorób rzadkich są zazwyczaj małe z konieczności. Planowanie badania klinicznego prowadzonego na małej grupie pacjentów, zwłaszcza w przypadku choroby rzadkiej, może nieść ze sobą pewne wyzwania. Badania przeprowadzane na małej grupie wykazują większą zmienność niż badania prowadzone na większych grupach pacjentów, co oznacza, że projekty standardowe mogą być właściwe tylko w przypadku oczekiwanego znacznego efektu.
Szczególne wymogi w zakresie badań w chorobach rzadkich sprawiają, że projekty adaptacyjne stają się wyjątkowo atrakcyjne. Klasyczne badania kliniczne dotyczące choroby rzadkiej są zazwyczaj ukierunkowane na obserwację znacznego efektu. Moc testu statystycznego to jego zdolność do wykrywania efektu, jeśli taki efekt faktycznie istnieje. Mówiąc językiem statystyki, jest to prawdopodobieństwo, że test prawidłowo prowadzi do odrzucenia hipotezy zerowej.
W niektórych wypadkach odrzucenie hipotezy zerowej może nie być możliwe, nie dlatego, że jest prawdziwa, ale z powodu braku wystarczających dowodów jej nieprawdziwości. Taka sytuacja może wynikać z rozmiarów badania, niewystarczających do odrzucenia hipotezy zerowej. Moc testu można opisać jako prawdopodobieństwo niepopełnienia błędu typu II (nieodrzucenia fałszywej hipotezy zerowej).
Projekty adaptacyjne stanowią atrakcyjną alternatywę, ponieważ:
- Skracają proces opracowywania leku bez negatywnego wpływu na zasadność i skuteczność badania.
- Pozwalają na wcześniejszą identyfikację nieskutecznego sposobu leczenia.
- Umożliwiają bardziej efektywne wykorzystanie zasobów.
Jednak ważne jest, aby wiedzieć, co projekt adaptacyjny pozwoli lub nie pozwoli wykonać w przypadku chorób rzadkich. Przede wszystkim badania adaptacyjne nie mogą „uczynić” leku bardziej skutecznym. Mogą one jednak wcześniej zidentyfikować nieskuteczne sposoby leczenia. Taka wczesna identyfikacja może zminimalizować wykorzystanie środków przeznaczonych na badania poświęcone nieskutecznemu leczeniu i pozwolić na przesunięcie zasobów na bardziej obiecujące metody leczenia.
Możliwe podejścia w przypadku badania adaptacyjnego
Termin „adaptacyjny” obejmuje bogaty zestaw projektów, ale większość z nich posiada prostą strukturę. W ramach badania adaptacyjnego istnieją etapy zdobywania wiedzy i potwierdzania, które są podobne do ogólnego procesu opracowywania badań klinicznych w różnych konfiguracjach (faza I, faza II i faza III). W wyniku tego, zmiany mogą być wprowadzone do hipotez lub parametrów projektu.
Etapy zdobywania wiedzy:
- Można dokonać zmian w głównych elementach projektu (np. zrezygnować z ramion badania).
- Niepewność statystyczna (np. błąd systematyczny, zmienność, nieprawidłowy wybór).
- Ocena efektów leczenia (korzystne lub niekorzystne).
Etapy potwierdzania:
- Kontrola błędów statystycznych i systematycznych błędów operacyjnych ma największe znaczenie
- Wymagana jest ścisła kontrola błędów typu I (np. określono dane leczenie jako skuteczne, gdy w rzeczywistości takie nie jest).
Najczęściej stosuje się projekty adaptacyjne w przypadku badań wykorzystujących zasady wczesnego przerwania badania z powodu bezcelowości (gdy leczenie lub badanie nie daje żadnych użytecznych wyników) lub braku skuteczności.
Zasady te są wstępnie określone i weryfikowane przez jedną lub więcej analiz okresowych. Zapobiegają stosowaniu leków, które nie gwarantują korzystnego wpływu lub są niebezpieczne. A co najważniejsze, w przypadku stwierdzenia, że lek badany jest bardziej skuteczny klinicznie niż lek kontrolny, dalsze podawanie mniej skutecznego leku kontrolnego byłoby nieetyczne. Zasady wczesnego przerwania badania z powodu bezcelowości umożliwiają zaprzestanie podawania mniej skutecznego leku kontrolnego.
Istnieją również schematy, w których rezygnuje się z ramion badania w trakcie jego trwania lub wybiera się podgrupy w oparciu o odpowiednie biomarkery.
Niektóre projekty umożliwiają ponowną ocenę wielkości próby, na przykład wzrost populacji pacjentów w sytuacji, gdy pojawiają się obiecujące wyniki.
Randomizacja adaptacyjna jest kolejnym przykładem intuicyjnie poprawnego projektu. W przypadku tego schematu większy odsetek pacjentów znajdzie się w „lepszej” grupie (jeśli taka istnieje). Te projekty adaptacyjne badań oparte są głównie na niemieszanych analizach okresowych, które oceniają wpływ leczenia — co oznacza, że analitycy wiedzą, do których grup leczenia zostali przydzieleni uczestnicy badania.
Przykłady badań adaptacyjnych
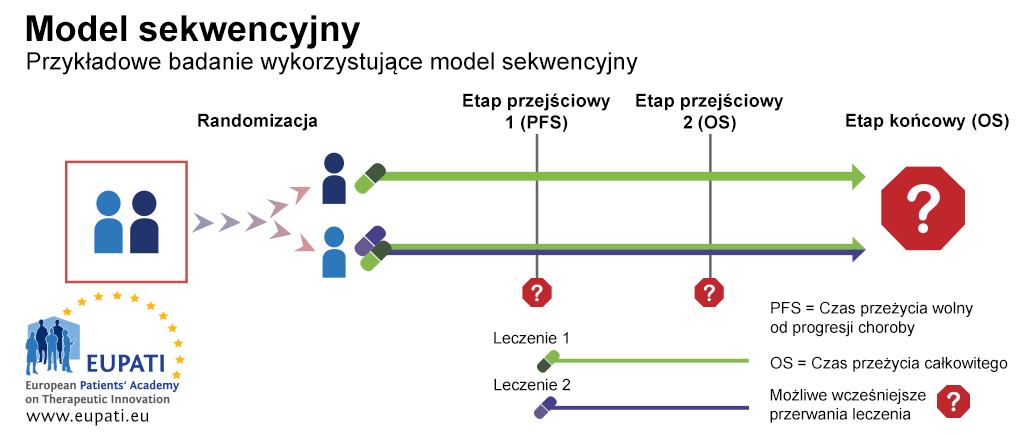
Przykład 1: Model sekwencyjny
Model sekwencyjny jest typowym przykładem badania fazy III wykorzystującym zasady wczesnego przerwania badania z powodu bezcelowości lub braku skuteczności. W przykładowym badaniu przedstawionym na schemacie poniżej pacjenci zostali przydzieleni losowo do grup leczenia pierwszego rzutu tj. grupy, której podaje się jeden lek lub grupy, u której zastosowano kombinację obu leków.
Istniały dwa etapy przejściowe, w trakcie których można było wcześniej przerwać badanie i wykonać analizy zanim zebrano wszystkie wyniki badania. Badanie można było zatrzymać:
- Na etapie przejściowym 1 z powodu bezcelowości dalszego badania w oparciu o czas przeżycia wolny od progresji (ang. progression-free survival, PFS) — u pacjenta nie zaobserwowano rozwoju jakiegokolwiek nowotworu lub progresja choroby ma miejsce.
- Na etapie przejściowym 2 z powodu bezcelowości dalszego badania w oparciu o czas przeżycia całkowitego.
Model sekwencyjny jest klasycznym przykładem często zapominanym, gdy myśli się o badaniach adaptacyjnych, gdyż był już wykorzystywany zanim inne projekty adaptacyjne stały się bardziej powszechne. Możliwości adaptacyjne są planowane z góry w projektach badań, co pozwala na łatwe dopasowanie mocy i błędu typu I lub testów sekwencyjnych podczas przeprowadzania wielu testów. Zachowuje to całkowitą moc testu i błąd typu I.
- Model sekwencyjny umożliwia wcześniejsze zakończenie badania w oparciu o czas przeżycia bez progresji choroby lub czas przeżycia całkowitego. W tym przykładzie uczestnicy są przydzielani losowo do jednego z dwóch ramion badania i otrzymują leczenie 1 lub kombinację leczenia 1 i leczenia 2.
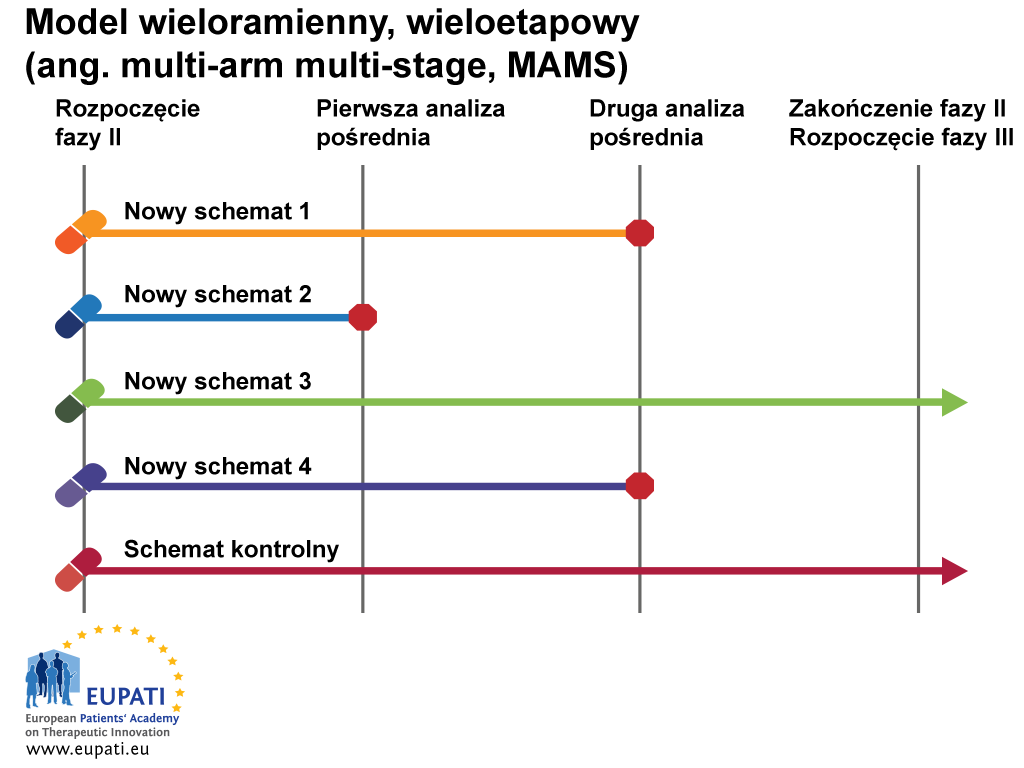
Przykład 2: Model wieloramienny, wieloetapowy (ang. multi-arm multi-stage, MAMS)
Badanie wieloramienne, wieloetapowe (MAMS) jest nowym paradygmatem prowadzenia badań z randomizacją, który wykorzystuje ciekawy projekt adaptacyjny.
Badania wykorzystujące model MAMS umożliwiają jednoczesną ocenę szeregu zabiegów będących przedmiotem badania względem pojedynczego ramienia kontrolnego. Badania MAMS pozwalają na uzyskanie odpowiedzi wcześniej i są potencjalnie bardziej opłacalne niż przeprowadzenie kilku tradycyjnie zaprojektowanych badań.
W tym przykładzie widzimy, że model wykorzystuje wiele ramion i etapów w tym samym czasie.
Model MAMS wymaga rozstrzygających głównych i pośrednich wskaźników skuteczności. Rozstrzygający wskaźnik skuteczności to ten, na którym powinny się opierać końcowe wnioski; pośredni wskaźniki skuteczności dostarcza narzędzi do „przesiewu” pojawiających się dowodów.
- Model wieloramienny, wieloetapowy (ang. multi-arm multi-stage, MAMS) umożliwia jednoczesną ocenę szeregu zabiegów względem pojedynczego ramienia kontrolnego.
Podczas pierwszej analizy pośredniej w powyższym przykładzie uznano, że w przypadku Nowego schematu 2 brak wystarczających dowodów wskazujących wyższość leczenia w porównaniu z leczeniem standardowym i dlatego badania w ramach etapu 2 nie będą kontynuowane. Podczas drugiej analizy pośredniej wstrzymano rekrutację do Nowych schematów 1 i 4 i tylko leczenie kontrolne oraz Nowy schemat 3 będą kontynuowane do końca badania i przejdą do fazy III.
Zalety modelu MAMS:
- Mniej pacjentów W przypadku tego modelu prowadzi się jednocześnie kilka badań, co pozwala zredukować liczbę pacjentów przydzielonych losowo do grupy kontrolnej.
- Krótszy czas potrzebny do odkrycia leku Etapy pośrednie modelu MAMS zastępują oddzielny etap fazy II. Podjęcia decyzji o ewentualnej skuteczności leku znalazło odzwierciedlenie w fazie pilotażowej niniejszego badania.
- Mniej wniosków i zatwierdzeń Działania rejestracyjne są wykonywane dla jednego badania, a nie kilku.
- Elastyczne Można usunąć nieinteresujące ramiona badania lub dodać nowe.
- Redukcja kosztów Ten model badania wymaga mniej pacjentów, mniej wniosków rejestracyjnych i mniej czasu; wszystko to pozwala zaoszczędzić koszty przeznaczone na rozwój.
Wady modelu MAMS:
- Właściwości operacyjne Ze względu na złożoność tego podejścia może on być trudny do przeprowadzenia i wymaga wiele symulacji na etapie projektowania.
- Wymagana liczba pacjentów
Zależy od charakterystyki operacyjnej; jeżeli dodaje się ramiona w trakcie badania, wówczas można napotkać na trudności na etapie przewidywania budżetu oraz kwestii rejestracyjnych.
- Czas trwania badania
Jeżeli dodaje się ramiona badania, wówczas trudno przewidzieć czas zakończenia badania.
- Ciągły przyrost (nabór do) ramienia kontrolnego Aby uniknąć błędu z tytułu czasu w przypadku, gdy dodaje się nowe ramiona badania, należy stale prowadzić nabór do ramienia kontrolnego w trakcie trwania badania. Ponadto, należy wziąć pod uwagę, co się stanie, jeśli pojawi się nowe standardowe leczenie w trakcie trwania badania — czy leczenie kontrolne jest nadal aktualne?
- Porównanie ramion eksperymentalnych Model MAMS pozwala jedynie na porównanie poszczególnych ramion badania i ramienia kontrolnego; nie pozwala na porównanie między sobą poszczególnych ramion badania.
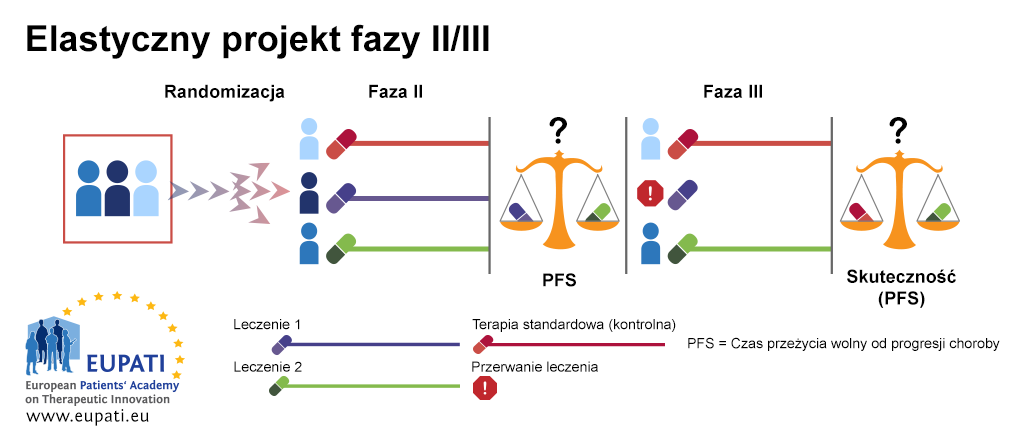
Przykład 3: Elastyczny projekt fazy II/fazy III
Elastyczny projekt fazy II/fazy III jest często wykorzystywany w przypadku chorób rzadkich; jest także znany pod nazwą „testu złożonego”. W poniższym przykładzie pacjenci zostają losowo przydzieleni do trzech ramion badania w pierwszym etapie projektu (Faza IIb). Pierwsze ramię badania stanowi grupę kontrolną i pacjenci do niej przydzieleni otrzymują standardową opiekę medyczną. Pacjenci przydzieleni do ramienia drugiego i trzeciego otrzymują inny rodzaj leczenia, Leczenie 1 lub Leczenie 2.
Na koniec etapu pierwszego (Fazy IIb) zostaje porównane Leczenie 1 i Leczenie 2 w oparciu o najlepszy czas przeżycia wolny od progresji (ang. progression-free survival, PFS). Najmniej skuteczne leczenie (ramię) zostanie wyeliminowane. Następnie prowadzi się drugi etap (Fazę III) badania z wykorzystaniem drugiego ramienia. Na tym etapie porównuje się skuteczność leczenia w stosunku do opieki standardowej.
- Elastyczny projekt fazy II/III umożliwia wykonanie fazy II oraz fazy III w ramach jednego badania.
Zalety elastycznego projektu fazy II/fazy III
- Pomaga „złagodzić” błąd systematyczny Oba etapy prowadzi się niezależnie, a ich wyniki zostają połączone na końcu dając wynik ogólny.
- Skraca czas i narażenie pacjenta
Faza II i faza III są wykonywane w ramach jednego badania.
- Stosunkowo elastyczny Stosunkowo elastyczny sposób, w jaki wybrano ramię badania w ramach fazy II i połączono z fazą III w celu ostatecznego porównania.
- Efektywne wykorzystanie zasobów
Dane pacjentów z fazy II i III mają udział w końcowych wynikach.
Wady
- Skomplikowane analizy statystyczne
Ten model wymaga aspektów statystycznych, które nie są takie proste.
- Luki w rekrutacji Istnieje luka w rekrutacji między dwoma fazami, gdyż należy zebrać wystarczającą ilość danych (potrzeba na to czasu) celem przeprowadzenia analizy pośredniej, na podstawie której zostanie podjęta decyzja o ewentualnym kontynuowaniu badania.
- Wyzwania logistyczne Ten model jest trudny logistycznie — wymaga szybkiego przepływu danych, tak, aby można było reagować na analizowaną liczbę zdarzeń.
- Trudności wynikające z długookresowych punktów końcowych Ten model wymaga, aby informacja na temat PFS była znana stosunkowo szybko. To staje się trudniejsze, gdy mamy do czynienia z długookresowymi punktami końcowymi.
- Ryzyko utraty danych Połączenie dwóch ramion może doprowadzić do utraty danych
Współpraca z pacjentami
Wkład pacjenta do badania adaptacyjnego może pomóc badaczom w określeniu najbardziej odpowiedniego projektu, przyczyniając się do zdefiniowania i zrozumienia potrzeb i wymagań populacji pacjentów. Pacjenci mogą się także angażować w prace Komitetu ds. Monitorowania Danych.
Wnioski
Nowe projekty badań mogą pozwolić na:
- Elastyczne strategie projektowania
- Bardziej efektywne wykorzystanie zasobów
- Krótszy proces opracowywania leków
Z punktu widzenia przepisów, ważne jest zachowanie integralności i ważności w projektach adaptacyjnych wykorzystywanych w badaniach klinicznych:
- Zadają to samo pytanie, co klasyczny projekt badania
- Kontrola błędów systematycznych
- Kontrola możliwych statystycznie znaczących błędów
- Interpretacja wyników
Załączniki
A2-4.08-v1.2