Nieuwe benaderingen van klinische onderzoeken: adaptieve opzetten
Inleiding
In het traditionele ontwerp van een klinisch onderzoek moet elke nieuwe behandeling een strikt ontwikkelingsproces doormaken. Na succesvolle klinische Fase I-onderzoeken moet er een klinisch Fase II-onderzoek worden uitgevoerd om voldoende werkzaamheid en veiligheid aan te tonen. Wanneer dit is aangetoond, wordt het geneesmiddel beoordeeld in klinische Fase III-onderzoeken, waar het wordt vergeleken met een standaardbehandeling (controle). Om dit voor elke behandeling afzonderlijk uit te voeren vraagt veel tijd, een groot aantal patiënten en aanzienlijke financiële middelen. Bovendien zijn bij de traditionele benadering tijdens de uitvoering van het onderzoek geen wijzigingen toegestaan.
Een nieuwe benadering van klinische onderzoeken is een adaptieve opzet. Adaptieve klinische onderzoeken bevatten een vooraf geplande gelegenheid om een of meer gespecificeerde aspecten van het onderzoek te wijzigen. Dit wordt doorgaans gebaseerd op de analyse van tussentijdse gegevens van deelnemers tijdens het onderzoek.
Er zijn veel redenen om in klinische onderzoeken een adaptieve opzet (of adaptieve routes) toe te passen. In een omgeving die onder economische druk staat, blijkt een adaptieve opzet aantrekkelijk te zijn voor de farmaceutische industrie, academische instellingen, artsen en patiënten.
Adaptieve opzetten
Een adaptieve opzet is een relatief flexibele opzet van een klinisch onderzoek, die tijdens de uitvoering van het onderzoek wijzigingen toestaat om het proces te stroomlijnen en optimaliseren. Op vooraf geplande tijdstippen binnen het onderzoek kunnen volledige geblindeerd of ongeblindeerd analyses van de toenemende hoeveelheid onderzoeksgegevens worden uitgevoerd zowel met als zonder formele statistische tests van de hypothese. Het is belangrijk dat het proces alleen zo wordt gewijzigd dat de validiteit en integriteit van het onderzoek niet worden aangetast.
Een adaptieve opzet kan operationele problemen met zich meebrengen vanwege de complexiteit ervan, en het proces van aanpassing van een klinisch onderzoek kan bias introduceren. Deze bias kan statistisch of operationeel zijn – als een aanpassing bijvoorbeeld suggereert dat de resultaten van een klinisch onderzoek in een bepaalde richting wijzen.
De adaptieve opzet kan voor de sponsor en de deelnemers aan het onderzoek de doeltreffendheid ervan verbeteren. Als een dergelijk onderzoek echter niet correct wordt uitgevoerd, is er grote kans dat het klinische resultaten oplevert die lastig zijn te interpreteren of te vertalen naar de dagelijkse praktijk.
Adaptieve opzet bij zeldzame ziekten
Klinische onderzoeken voor zeldzame ziekten zijn doorgaans uit noodzaak kleinschalig. Het plannen van een kleinschalig klinisch onderzoek, in het bijzonder voor een zeldzame ziekte, kan verscheidene uitdagingen met zich meebrengen. Kleine onderzoeken vertonen meer variabiliteit dan grotere; dit impliceert dat een standaardopzet kan leiden tot onderzoeken die alleen geschikt zijn om grote effecten aan te tonen.
De specifieke eisen voor klinische onderzoeken naar zeldzame ziekten maken met name een adaptieve opzet aantrekkelijk. Klassieke onderzoeken voor zeldzame ziekten zijn doorgaans alleen in staat om grote effecten zichtbaar te maken Het onderscheidend vermogen (‘power’) van een statistische test is het vermogen van de test om een effect op te sporen, als het effect ook werkelijk bestaat. In statistische termen is het de kans dat het op juiste wijzen zal leiden tot het verwerpen van een nulhypothese.
In sommige gevallen zijn we mogelijk niet in staat de nulhypothese te verwerpen, niet omdat deze waar is maar omdat we er niet voldoende bewijs tegen hebben. Dit kan het geval zijn omdat het experiment niet groot genoeg is om de nulhypothese te verwerpen. Als zodanig kan het onderscheidend vermogen van een test worden beschreven als de waarschijnlijkheid dat er geen type II-fout wordt gemaakt (de nulhypothese niet verwerpen wanneer deze in feite onjuist is).
Adaptieve opzetten bieden een aantrekkelijk alternatief omdat:
- Ze het ontwikkelingsproces bekorten zonder dat de validiteit of doeltreffendheid in gevaar komt
- Ineffectieve behandelingen eerder kunnen worden vastgesteld
- Ze een efficiënter gebruik van hulpmiddelen mogelijk maken.
Het is echter belangrijk te erkennen wat een adaptieve opzet wel of niet kan doen in het geval van zeldzame ziekten. Wat heel belangrijk is dat een adaptieve opzet een geneesmiddel niet effectiever kan maken. Een dergelijke opzet kan echter wel ineffectieve behandelingen eerder identificeren. Door zo’n vroege identificatie worden er zo weinig mogelijk van de voorzieningen gebruikt voor het onderzoek van een ineffectieve behandeling en kunnen de voorzieningen vervolgens worden gebruikt voor meer veelbelovende behandelingen.
Mogelijke benaderingen bij een adaptieve opzet
De term ‘adaptief’ omvat een gevarieerde groep van onderzoeksopzetten, maar de meeste ervan hebben een eenvoudige structuur. Binnen een adaptief klinisch onderzoek zijn er leer- en bevestigingsfasen, met een benadering die vergelijkbaar is met het algehele klinische ontwikkelingsproces binnen meerdere onderzoeksettings (Fase I, Fase II en Fase III). Daardoor kunnen er veranderingen worden aangebracht in hypothesen of de parameters van de opzet.
Leerfasen:
- Belangrijke elementen van de opzet kunnen worden gewijzigd (bijvoorbeeld behandelarmen laten vervallen)
- Statistische onzekerheid (bijvoorbeeld bias, variabiliteit, onjuiste selectie)
- Schatting van de behandeleffecten (gunstig of nadelig)
Bevestigingsfasen:
- Controle over statistische fouten en operationele bias is uiterst belangrijk
- Strenge beheersing van type I-fouten is vereist (bijvoorbeeld de bevinding dat een behandeling efficiënt is wanneer deze dat in feite niet is).
De meest gebruikte adaptieve opzetten zijn klinische onderzoeken met regels voor vroegtijdige stopzetting wegens futiliteit (wanneer de behandeling of het onderzoek geen bruikbare resultaten oplevert) of werkzaamheid.
Deze regels worden vooraf vastgesteld en geverifieerd door een of meer interim-analyses. Ze voorkomen dat deelnemers geneesmiddelen innemen die geen gunstig effect opleveren of onveilig zijn. Heel belangrijk is dat als wordt gevonden dat het onderzoekgeneesmiddel klinisch effectiever is dan de controle, het onethisch zou zijn het minder effectieve controlegeneesmiddel te blijven toedienen. Regels voor vroegtijdig stoppen vanwege futiliteit maken het mogelijk de toediening van een minder effectief controlegeneesmiddel stop te zetten.
Er zijn ook opzetten waarbij in de loop van een klinisch onderzoek behandelarmen worden stopgezet of waarbij een subpopulatie wordt geselecteerd op basis van een biomarker waar de belangstelling naar uitgaat.
Sommige opzetten maken herschatting van de steekproef mogelijk, bijvoorbeeld een toename in de patiëntenpopulatie als de resultaten veelbelovend lijken.
Adaptieve randomisatie is een ander voorbeeld van een intuïtief aantrekkelijke opzet. Bij deze opzet zou een groter deel van de patiënten worden behandeld met de ‘betere’ arm (als die er is). Deze adaptieve onderzoeksopzetten worden grotendeels gebaseerd op ongeblindeerde interim-analyses die de behandeleffecten schatten – wat inhoudt dat de analisten weten bij welke behandeling deelnemers waren ingedeeld.
Voorbeelden van een adaptieve onderzoeksopzet
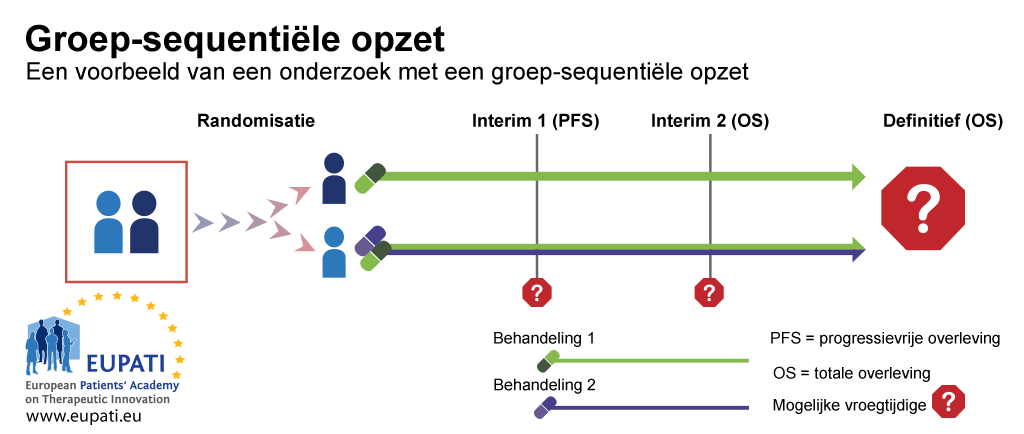
Voorbeeld 1: Groep-sequentiële opzet
Een groep-sequentiële opzet is een typisch voorbeeld van een klinisch Fase III-onderzoek met regels voor vroegtijdige stopzetting wegens futiliteit of werkzaamheid. In het voorbeeldonderzoek afgebeeld in onderstaande schematische weergave werden patiënten gerandomiseerd naar de eerstelijnsbehandeling met alleen één geneesmiddel of met twee geneesmiddelen in combinatie.
Er waren twee tussentijdse stadia waarin het mogelijk was het onderzoek vroegtijdig stop te zetten en een analyse uit te voeren vóór alle onderzoeksresultaten zijn verzameld. Het onderzoek kon worden stopgezet:
- Bij interim 1, wegens futiliteit gebaseerd op progressievrije overleving (PFS) – of bij de patiënt wel of geen progressie van een specifieke vorm van kanker optreedt
- Bij interim 2, wegens futiliteit of werkzaamheid gebaseerd op de algehele overleving.
Een groep-sequentiële opzet is een klassiek voorbeeld dat vaak wordt vergeten wanneer wordt gedacht over een adaptieve opzet, aangezien het al werd toegepast voordat andere adaptieve opzetten gangbaarder werden. Gelegenheden voor adaptatie worden van te voren tijdens het ontwerpen van het onderzoek gepland; dit leidt ertoe dat het onderscheidend vermogen en de type I-fout van sequentiële testen relatief gemakkelijk zijn aan te passen wanneer meerdere testen worden uitgevoerd. Dit heeft dan geen invloed op het algehele onderscheidend vermogen en de type I-fout.
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Een groep-sequentiële opzet maakt vroegtijdige stops mogelijk op basis van progressievrije overleving of algehele overleving. In dit voorbeeld werden de deelnemers gerandomiseerd naar een van twee armen en kregen ze behandeling 1 of een combinatie van behandeling 1 en behandeling 2.
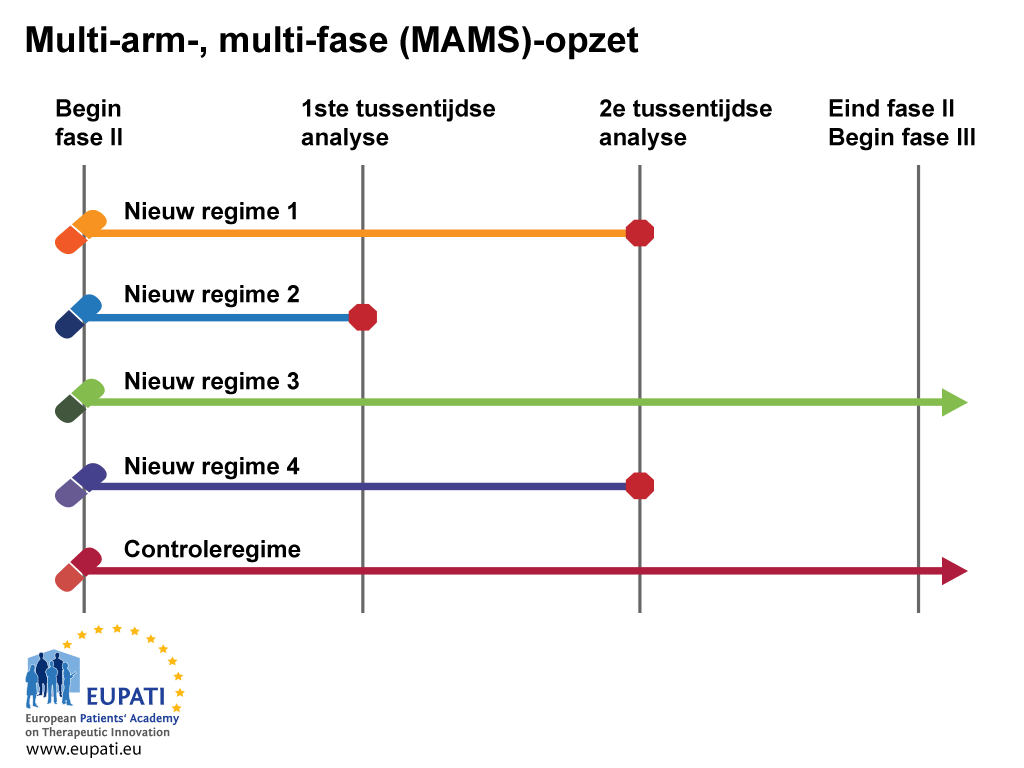
Voorbeeld 2: ‘Multi-arm multi-stage’ (MAMS) -opzet
Het ‘multi-arm multi-stage’ (MAMS)-onderzoek (onderzoek met meerdere armen en meerdere stadia) is een nieuw model voor het uitvoeren van gerandomiseerde gecontroleerde klinische onderzoeken waarin gebruik wordt gemaakt van een interessante adaptieve opzet.
MAMS-onderzoeken maken de gelijktijdige beoordeling mogelijk van een aantal onderzoeksbehandelingen tegen een enkele controlearm. MAMS-onderzoeken leveren eerder antwoorden op en zijn in potentie kosteneffectiever dan een reeks traditioneel opgezette onderzoeken.
In dit voorbeeld zien we een opzet waarin tegelijk van meerdere armen en stadia gebruik wordt gemaakt.
De MAMS-opzet vereist een definitieve primaire en intermediaire primaire uitkomstmaat. De definitieve uitkomstmaat is de maat waarop de eindconclusies moeten worden gebaseerd; de intermediaire uitkomstmaat biedt een middel voor screening op opkomend bewijs voor effectiviteit.
#mla_gallery-2 { margin: auto; width: 100%; } #mla_gallery-2 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-2 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-2 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Met de ‘multi-arm multi-stage’ (MAMS)-opzet (opzet met meerdere armen en meerdere stadia) is het mogelijk meerdere behandelingen tegelijk te testen ten opzichte van een enkelvoudige controlegroep.
Bij de eerste interim-analyse in het voorbeeld hierboven wordt geoordeeld dat het nieuwe regime 2 onvoldoende voordeel oplevert in vergelijking met de controlegroep en niet doorgaat naar stadium 2. Bij de tweede interim-analyse wordt de werving voor de nieuwe regimes 1 en 4 stopgezet en worden alleen het controleregime en het nieuwe regime 3 voortgezet tot het einde van het klinische onderzoek en doorgeschoven naar klinische Fase III-onderzoeken.
Voordelen van de MAMS-opzet:
- Minder patiënten
In deze opzet worden diverse onderzoeken tegelijk uitgevoerd, waardoor er minder patiënten hoeven te worden gerandomiseerd naar de controlearm. - In totaal minder tijd nodig om een geneesmiddel te ontdekken
De tussenstappen van de MAMS-opzet vervangen de afzonderlijke Fase II-stap. De beslissing of het geneesmiddel voldoende werkzaam is, wordt als een pilot-fase in dit klinische onderzoek ingebouwd. - Minder aanvragen en goedkeuringen vereist
Regelgevingsprocedures worden doorlopen voor één in plaats van voor meerdere onderzoeken. - Flexibel
Niet-interessante armen kunnen worden stopgezet en nieuwe armen kunnen worden toegevoegd. - Lagere kosten
Deze onderzoeksopzet vereist minder patiënten, minder vergunningaanvragen en een kortere doorlooptijd, wat de ontwikkelingskosten drukt.
Nadelen van de MAMS-opzet:
- Operationele kenmerken
Vanwege de complexiteit van deze benadering kan het lastig zijn deze te managen en zijn er tijdens het opzetten talrijke simulaties nodig. - Vereiste aantal patiënten
Dit hangt af van de operationele kenmerken, maar als er in de loop van het onderzoek behandelarmen worden toegevoegd, kan het lastig zijn voorspellingen te doen wat betreft het budget en regelgevingskwesties. - Onderzoeksduur
Als er behandelarmen worden toegevoegd, wordt het lastig te voorspellen wanneer het onderzoek wordt beëindigd. - Voortgezette werving (rekrutering) voor controlearm
Om ‘time bias’ te voorkomen wanneer nieuwe behandelarmen worden toegevoegd, moet gedurende het hele onderzoek de rekrutering voor de controlearm worden voortgezet. Ook moet worden nagedacht over wat er gebeurt als er tijdens het onderzoek een nieuwe standaardzorg beschikbaar komt – is de controlegroep nog steeds relevant? - Vergelijking tussen experimentele armen
De MAMS-opzet staat alleen vergelijking toe tussen de afzonderlijke behandelarmen en de controlearm; vergelijking van afzonderlijke behandelarmen onderling is niet toegestaan.
Voorbeeld 3: Opzet met naadloze overgang Fase II/Fase III
De opzet met naadloze Fase II/Fase III wordt vaak gebruikt in het geval van zeldzame ziekten; deze opzet wordt ook een ‘combinatietest’ genoemd. In het voorbeeld hieronder worden patiënten in het eerste stadium van de opzet (Fase IIb) gerandomiseerd naar een van drie behandelarmen. De eerste behandelarm is de controlearm, waarin patiënten de standaardbehandeling krijgen. Patiënten in de tweede en derde behandelarmen krijgen verschillende behandelingen, behandeling 1 of behandeling 2.
Aan het eind van het eerste stadium (Fase IIb), worden behandeling 1 en behandeling 2 vergeleken op basis van de beste progressievrije overleving (PFS). De minst effectieve arm komt te vervallen. De andere behandelarm wordt dan gecontinueerd in het tweede stadium (Fase III). In dit stadium wordt de werkzaamheid vergeleken met de standaardbehandeling.
#mla_gallery-3 { margin: auto; width: 100%; } #mla_gallery-3 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-3 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-3 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Met de opzet met naadloze overgang Fase II/Fase III kunnen Fase II en Fase III worden uitgevoerd binnen de context van één klinisch onderzoek.
Voordelen van de opzet met naadloze overgang Fase II/Fase III
- Helpt bias te verminderen
Beide stappen worden onafhankelijk van elkaar uitgevoerd en de resultaten van beide stappen worden aan het eind gecombineerd tot een algeheel testresultaat. - Bekort de tijd en de blootstelling van patiënten
Fase II en Fase III worden binnen de context van één onderzoek uitgevoerd. - Relatief flexibel
De wijze waarop de behandelarm in het Fase II-gedeelte voor een definitieve vergelijking wordt gekozen en samengevoegd met het Fase III-gedeelte, is relatief flexibel. - Efficiënt gebruik van hulpmiddelen
Patiënten van zowel Fase II als Fase III dragen beide bij aan de definitieve resultaten.
Nadelen
- Gecompliceerde statistische analyses
Deze opzet vereist statistische aspecten die niet zo duidelijk zijn. - Hiaten in de rekrutering
Er is sprake van een hiaat in de rekrutering tussen beide fasen terwijl er wordt gewacht tot er voldoende gegevens zijn verzameld om de interim-analyse uit voeren aan de hand waarvan wordt besloten om wel of niet verder te gaan. - Logistieke problemen
Deze opzet vormt een logistieke uitdaging – er is een snelle stroom van gegevens nodig zodat het aantal voorvallen in de analyse kan worden gevolgd. - Problemen die ontstaan door eindpunten op lange termijn
Voor deze opzet moet informatie over PFS relatief snel beschikbaar zijn. Dit wordt lastiger wanneer het eindpunten op lange termijn betreft. - Risico van verloren gegane informatie
Combineren van twee armen brengt het risico van verlies van informatie met zich mee
Samenwerking met patiënten
Input van patiënten in een adaptieve opzet kan onderzoekers helpen de geschiktste opzet vast te stellen door de behoeften en eisen van de patiëntenpopulatie te helpen definiëren en begrijpen. Patiënten kunnen ook worden betrokken bij het ‘Data Monitoring Committee’ (onafhankelijke commissie voor gegevenscontrole).
Conclusies
Nieuwe onderzoeksopzetten kunnen het volgende mogelijk maken:
- Strategieën met een flexibele opzet
- Efficiënter gebruik van hulpmiddelen
- Korter ontwikkelingsproces
Vanuit regelgevend oogpunt is het belangrijk de validiteit en integriteit van de adaptieve opzet bij klinische onderzoeken te handhaven:
- Dezelfde vraagstelling hanteren als in de klassieke onderzoeksopzet
- Operationele bias onder controle houden
- Mogelijke statistisch significante fouten onder controle houden
- Interpretatie van de resultaten
Bijlagen
#mla_gallery-4 { margin: auto; width: 100%; } #mla_gallery-4 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-4 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-4 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Principes van nieuwe onderzoeksopzetten
Size: 695,741 bytes, Format: .pptx
Deze presentatie beoordeelt het traditionele model voor klinische ontwikkeling en bespreekt alternatieven, in het bijzonder het adaptieve ontwerp voor klinische onderzoeken.
A2-4.08-v1.2