Neue Forschungsgebiete bei den personalisierten Arzneimitteln
Es gibt neue Forschungsgebiete, die die personalisierte Medizin vorantreiben:
Molekulargenetik
Die aktuelle Forschung liefert uns eine Vielzahl von Erkenntnissen zu Erkrankungen auf zellulärer und molekularer Ebene. Es liegen Nachweise dafür vor, dass bestimmte Änderungen an Genen (Abweichungen) beeinflussen können, wie Zellen funktionieren und eine Erkrankung sich entwickelt. Erkrankungen mit ähnlichen Symptomen können als dieselbe Erkrankung diagnostiziert werden. Tatsächlich jedoch werden sie möglicherweise durch unterschiedliche genetische Abweichungen erzeugt.
Epigenetik
Dieser wachsende Bereich unterstützt uns dabei, Variationen einer Erkrankung zu verstehen. Epigenetik befasst sich mit der Erforschung von Möglichkeiten, Gene ohne Änderungen an ihrer DNA-Sequenz „ein- und auszuschalten“ bzw. zu modulieren („zu verstärken und abzuschwächen“). Epigenetische Änderungen können die Art und Weise beeinflussen, in der Patienten auf eine Behandlung ansprechen, da die Änderungen in Reaktion auf umgebungs- oder lebensweisebedingte Faktoren wie die Exposition gegenüber UV-Licht, Ernährung, Rauchen oder Stress auftreten können. Letztendlich würde eine personalisierte Medizin die Epigenetik des Einzelnen berücksichtigen.
Biomarker und Arzneimittelentwicklung
Auf zellulärer und molekularer Ebene ablaufende Prozesse können mittels „Biomarkern“ gemessen werden. Einige Beispiele für Biomarker:
- Physiologische Messwerte wie Blutdruck oder Temperatur
- Biologische Substanzen (Biochemikalien) wie Enzyme oder Hormone
- Genveränderungen
- MRT-Aufnahmen (Magnetresonanztomographie)
Biomarker finden bei der Arzneimittelentwicklung zunehmende Verwendung für die Schaffung von zielgerichteten Behandlungen. Hieran sind die folgenden Erwartungen geknüpft:
- Verbesserte Behandlungsergebnisse: Der Arzt sollte die Wahl unter Arzneimitteln haben, die bei jeder einzelnen Person gut wirken und ein geringeres Risiko schwerwiegender Nebenwirkungen aufweisen.
- Verbesserung der Effizienz der Arzneimittelentwicklung durch effizientere, weniger zeitaufwendige und sicherere nicht-klinische und klinische Studien.
Pharmakogenetik oder Pharmakogenomik
Eine in zunehmendem Ausmaß eingesetzte Art von Biomarker ist die genetische oder genomische Information eines Individuums. Die Untersuchung der Auswirkungen von Genetik bzw. Genomik auf das Ansprechen eines Individuums auf eine Behandlung wird als Pharmakogenetik bzw. Pharmakogenomik bezeichnet. Diese tragen dazu bei, eine Behandlung der genetischen Konfiguration des Individuums entsprechend „maßzuschneidern“. Eine Anzahl von heute auf dem Markt befindlichen Arzneimitteln erfordert vor der Verschreibung einen genetischen Test, mit dem sichergestellt wird, dass die Behandlung für den jeweiligen Patienten sicher ist. Zum Beispiel:
- HIV-Patienten werden auf eine als „HLA B*5701“ bezeichnete genetische Abweichung untersucht, bevor ihnen das Arzneimittel Abacavir verschrieben wird, da die Abweichung mit einer Nebenwirkung auf das Arzneimittel einhergeht.
Zudem weisen die Fachinformationen bestimmter anderer auf dem Markt befindlicher Arzneimittel den Arzt an, wie die genomische Information des Patienten bei der Verschreibung des Arzneimittels zu nutzen ist. Die genomischen Informationen können beitragen zu entscheiden, ob ein bestimmtes Arzneimittel die beste Option für den jeweiligen Patienten ist und in welcher Dosierung es verabreicht werden sollte. Zum Beispiel:
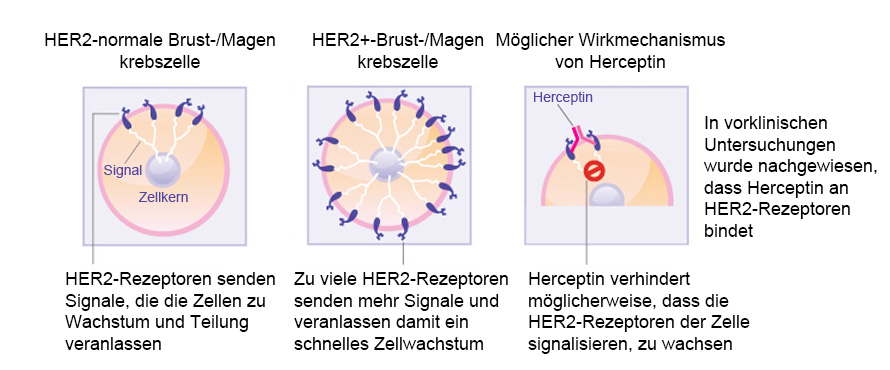
Trastuzumab (Herceptin) ist ein gen-gerichteter monoklonaler Antikörper, der gegen den humanen epidermalen Wachstumsfaktorrezeptor-2 (HER2) gerichtet und für die Behandlung von Brustkrebs im Frühstadium zugelassen ist. Bei ca. 20 % aller Brustkrebsfälle kommt es zu einer Überexpression von HER2, was eine übermäßige Signalisierung an das Zellinnere und damit wiederum ein immer schnelleres Wachstum der Brustkrebszellen verursacht. Nur Patienten, die positiv auf einen erhöhten HER2-Spiegel getestet wurden, werden von der Behandlung mit Trastuzumab profitieren. HER2 existiert auf der Oberfläche bestimmter Brustkrebszellen und wird in die Zellmembran geleitet. Trastuzumab funktioniert, indem es an die HER2-Rezeptoren an der Oberfläche der Brustkrebszellen anbindet und diese daran hindert, das Wachstum auslösende oder fördernde Signale zu empfangen. Durch die Blockierung der Signale kann Trastuzumab das Wachstum des Brustkrebses verlangsamen oder vollständig unterbinden; Herceptin ist damit ein Beispiel für eine immungerichtete Therapie.
- Wie Herceptin auf Brustkrebszellen wirkt. (Quelle: Siehe Verweis 1)
Biobanken
Untersuchungen unter Ausnutzung von Biobanken sind insbesondere für die Entwicklung personalisierter Arzneimittel von Bedeutung, und Biobanken finden bei klinischen Studien zu neuen Arzneimitteln zunehmend Anwendung. Im Prinzip sind Biobanken große, organisierte Sammlungen von Blut- und/oder Gewebeproben von Patienten und gesunden Freiwilligen. Außerdem umfassen sie sorgfältig erhobene Daten zum klinischen Zustand des Spenders, seiner Lebensweise (Ernährung, Rauchgewohnheiten usw.) und weiteren Faktoren. Biobanken ermöglichen die Untersuchung der Zellen und Moleküle einer großen Zahl von Proben und die Verknüpfung der gewonnenen Informationen mit klinischen und sonstigen Daten. Indem wir Informationen auf diese Weise miteinander kombinieren, gelangen wir zu einem besseren Verständnis um die Unterschiede zwischen einzelnen Individuen:
- Welche Krankheiten sie entwickeln
- Wie stark ausgeprägt ihre Krankheiten sind
- Wie sie auf Behandlungen ansprechen
Je mehr Proben verfügbar sind, desto effektiver können derartige Studien sein. In vielen Ländern werden derzeit Biobanken eingerichtet. „EuroBioBank“ ist ein Beispiel für eine Biobank, die in Zusammenarbeit verschiedener Länder entstand, um auf diese Weise noch mehr Daten für die Forschung (in diesem Fall die Erforschung seltener Krankheiten) verfügbar zu machen.
Quellenangaben
- How Herceptin affects breast cancer cells” by beyondthedish.wordpress.com is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License.
See: https://beyondthedish.wordpress.com/2012/06/04/smart-bomb-successfully-treat-advanced-breast-cancer-in-clinical-trials/
A2-1.08.2-V1.6