MTV-systemerne i Europa
Introduktion
Medicinsk teknologivurdering (MTV) er en tværfaglig proces, som sammenfatter information om medicinske, sociale, økonomiske og etiske spørgsmål, der er relateret til brugen af en medicinsk teknologi, på en systematisk, gennemsigtig, upartisk og pålidelig måde. Dens målsætning er at tjene som informationsgrundlag for udarbejdelsen af sikre og effektive sundhedspolitikker, der har patienten i fokus og sigter mod at opnå den bedste værdi. På trods af sine politiske mål skal MTV altid være fast forankret i forskning og videnskabelige metoder.
Når det gælder MTV på lægemiddelområdet, er det nyttigt at vide, hvordan lægemidler godkendes, og at have en grundlæggende forståelse af et lægemiddels livscyklus og de processer, der fører til en markedsføringstilladelse (Marketing Authorisation; MA). Det er ligeledes nyttigt at vide, hvordan MTV hænger sammen med tilskuds- eller sikringsordninger alt afhængigt af det pågældende land. Medicinalvirksomheden skal foretage randomiserede kliniske forsøg af høj kvalitet og indsende en ansøgning til den relevante lægemiddelmyndighed. Når lægemidlet har opnået markedsføringstilladelse på baggrund af sikkerhed, kvalitet og virkning, kan lægemidlet markedsføres (sælges). For at sikre patienterne en omfattende adgang til de nødvendige behandlinger, er det ofte nødvendigt, at lægemidlet dækkes af et nationalt sundhedssystem eller sygesikring. Det betyder, at lægemidlet bliver medtaget på den relevante nationale liste over de lægemidler, der gives tilskud til, eller som er omfattet af sygesikringen.
Samtidig skal disse institutionelle betalere administrere adgangen til innovative behandlinger inden for et begrænset budget. Som følge af disse begrænsninger ønsker betalerne at sikre, at de betaler for nye teknologier, der giver reelle forbedringer i patientresultaterne. Det er her, MTV kommer ind i billedet, da MTV’s grundlæggende rolle er at bestemme den nye teknologis terapeutiske merværdi (i form af helbredsresultater for patienterne) sammenlignet med de nuværende standardbehandlinger.
Et nyttigt udgangspunkt er at forstå, hvilke organisationer der spiller en hovedrolle i denne proces. I Europa er der forskellige organer, som er ansvarlige for både den lægemiddelrelaterede og den ikkelægemiddelrelaterede medicinske teknologivurdering (MTV). Disse organers struktur, funktion, ansvarsområde og tilgang varierer, alt efter de forskellige sundhedssystemer og politiske strukturer de opererer inden for.
Nogle eksempler på MTV-organer til lægemiddelvurdering i Europa er:
- Frankrig – Haute Autorité de Santé (HAS) – http://www.has-sante.fr
- Tyskland – Gemeinsamer Bundesausschuss (GBA) – https://www.g-ba.de/
- Skotland – Scottish Medicines Consortium (SMC) – scottishmedicines.org.uk/Home
- Sverige – Tåndvards Och Läkemedelsförmänsverket (TLV) – tlv.se/In-English/in-english/
Bemærk, at det i Tyskland er IQWIG (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen), som står for vurderingsdelen, mens GBA er ansvarlig for bedømmelsen og beslutningstagningen. Bemærk også, at i nogle europæiske lande foretager MTV-organet ligeledes evalueringer af ikkelægemiddelrelaterede interventioner såsom medicinsk udstyr, kirurgiske indgreb og (i nogle tilfælde) folkesundhedsinterventioner. Disse omfatter:
- Norge – NOKC (The Norwegian Knowledge Centre, Nasjonalt kunnskapssenter for helsetjenesten) – https://www.fhi.no/en/
- Sverige – SBU ( Swedish Agency for Health Technology Assessment and Assessment of Social Services) – http://www.sbu.se/en/
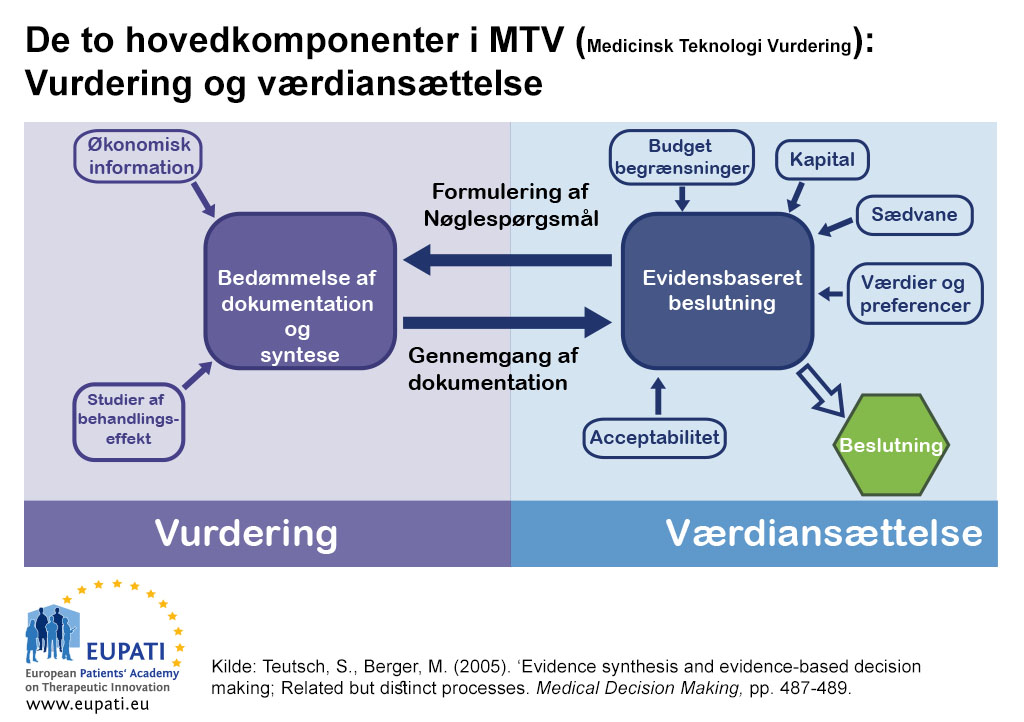
Der er to hovedelementer i MTV: vurdering og bedømmelse.
- Det gensidige forhold mellem vurdering og bedømmelse tjener som informationsgrundlag for beslutningstagningen i den medicinske teknologivurdering (MTV).
I nogle lande kan vurderings- og bedømmelsesfunktionerne i en MTV udføres af forskellige organer.
- Det ene organ kan være ansvarligt for vurderingsfunktionen – syntetisering af evidens eller en kritisk gennemgang af den forelagte evidens.
- Det andet organ kan være ansvarligt for bedømmelsesfunktionen – en bedømmelse af vurderingen set i lyset af nogle bredere faktorer, der er relateret til den lokale kontekst. Herefter giver de rådgivning eller anbefalinger.
MTV: vurdering
MTV-processerne for lægemidler begynder typisk med, at en virksomhed indsender et dossier med relevant information til et MTV-organ. Når det gælder interventioner, som ikke vedrører lægemidler, foretager MTV-organerne normalt en systematisk gennemgang af den offentliggjorte information. Dossieret omfatter som standard detaljeret evidens for den nye teknologis sikkerhed og virkning såvel som "yderligere kliniske fordele" – eller med andre ord en sammenligning af det nye produkts kliniske effektivitet med den eksisterende standardbehandling (komparator).
I nogle MTV-systemer i Europa estimeres det også, hvilken indvirkning det nye produkt kan have på sundhedssystemernes budget (en vurdering af budgetindvirkningen), eller hvor effektivt et lægemiddel er i forhold til dets omkostninger for systemet (f.eks. en analyse af omkostningseffektiviteten eller en økonomisk vurdering). Ikke i alle MTV-systemer i Europa lægges der samme vægt på en komparativ analyse af omkostningseffektiviteten, men de fokuserer alle på de yderligere kliniske fordele.
De mest almindelige elementer i et ansøgningsdosser eller en ansøgning er nævnt nedenfor. Bemærk, at nogle af disse elementer er mere kvantitative end andre. Aspekter, der vedrører retfærdighed, jura og folkesundhed, kan være mere kvalitative og kan derfor være medtaget i MTV's bedømmelsesdel frem for i vurderingsdelen.
- Målpatientpopulation: Den specifikke population, der skal tages i betragtning til dækningen (fastlægges ved hjælp af den fulde godkendte indikation eller en undergruppe inden for denne).
- Sygdomsbyrde: Også kendt som "uopfyldt behov" eller "terapeutisk behov". Dette kan være et mål for det antal personer, der lider af en bestemt sygdom, hvor de nuværende behandlinger er utilstrækkelige. Det kan omfatte antallet af nye diagnoser på en sygdom eller de omkostninger for samfundet eller en regering, som de syge udgør. Det kan også omfatte mere kvalitative aspekter af sygdomsbyrden og de nuværende behandlinger, der er tilgængelige for patienterne.
- Lægemiddelbeskrivelse: En beskrivelse af lægemidlet, hvordan det virker, hvordan det skal tages (f.eks. injektion eller tablet), hvor det administreres til patienterne (f.eks. et hospital, et sundhedscenter, hos den praktiserende læge eller hjemme), hvor ofte det skal tages samt dets korrekte brug i behandlingen sammen med andre interventioner og lægemidler.
- Klinisk virkning: Inden for lægevidenskaben angiver klinisk virkning en positiv terapeutisk effekt. Hvis en virkning bliver påvist, er det sandsynligt, at en intervention er mindst lige så god som andre tilgængelige interventioner, som den er blevet sammenlignet med.Når der tales om virkning over for effektivitet, måler virkning, hvor godt en behandling virker i kliniske forsøg eller laboratorieundersøgelser. Effektivitet siger på den anden side noget om, hvor godt en behandling virker, når den er alment tilgængelig.
- Relativ virkning: Herved forstås den udstrækning, i hvilken en intervention gør mere gavn end skade under de ideelle forhold sammenlignet med en eller flere alternative interventioner.
- Klinisk effektivitet: Klinisk effektivitet er et mål for, hvor godt en bestemt behandling virker, når den er alment tilgængelig. Det afhænger af anvendelsen af den bedst mulige viden fra forskning, klinisk erfaring og patientpræferencer.
- Relativ klinisk effektivitet: Dette kan defineres som den udstrækning, i hvilken en intervention gør mere gavn end skade sammenlignet med en eller flere alternative interventioner med det formål at opnå de ønskede resultater, når det sker under de sædvanlige sundhedsplejeomstændigheder.
- Økonomisk vurdering og omkostningseffektivitet: I forbindelse med farmakoøkonomi undersøges omkostningseffektiviteten ved at kigge på resultaterne af de forskellige interventioner og måle ét resultat, som regel i "naturlige" enheder (f.eks. ekstra leveår, undgåede dødsfald, undgåede hjerteanfald eller opdagede tilfælde).De alternative interventioner sammenlignes så med hensyn til omkostning pr. (naturlig) effektivitetsenhed for at vurdere, om de giver værdi for pengene. Dette hjælper beslutningstagerne med at bestemme, hvordan de begrænsede sundhedsressourcer skal allokeres.Omkostningseffektivitet er dog kun ét af en række kriterier, der anvendes til at bestemme, hvorvidt interventioner skal gøres tilgængelige eller ej. Andre spørgsmål, såsom retfærdighed, behov, indflydelse på arbejdslivet og patientprioriteringer, bør også indgå i den økonomiske vurdering.
- Budgetindvirkning: Omkostningerne inden for en bestemt tidsramme og i forbindelse med et bestemt sundhedsbudget frem for et lands samlede budget. Dette kræver pålidelige data om epidemiologi og behandlingsmønstre samt antagelser om anvendelse og fortrængning af nuværende behandlinger.
- Innovative karakteristika: En vurdering af, om der er fordele ved at bruge lægemidlet ud over de yderligere kliniske fordele (såsom nemheden for patienterne ved f.eks. en anden indgivelsesmåde eller andre karakteristika, der kan forbedre behandlingens overholdelse, med heraf følgende forbedringer i de kliniske resultater og/eller livskvaliteten).
- Tilgængeligheden af terapeutiske alternativer: En beskrivelse af, hvad der ellers findes til at behandle sygdommen. Dette kan evt. være et andet lægemiddel.
- Overvejelser om retfærdighed: En vurdering af, hvordan godkendelsen af den nye behandling kan få indflydelse på retfærdighedsforanstaltningerne i sundhedssystemet. Vil behandlingen f.eks. give flere fordele for personer, som er socialt eller økonomisk ugunstigt stillet?
- Indvirkning på folkesundheden: En undersøgelse af, hvordan den nye behandling kan have en bredere indvirkning på folkesundheden. F.eks. kan en ny behandling af hiv/aids reducere hiv-smitteraten i et samfund.
De fleste MTV-organer har udarbejdet retningslinjer for virksomhederne for at gøre denne proces konsekvent og skabe et fair sammenligningsgrundlag. Retningslinjerne er dog forskellige fra land til land. De er tilgængelige på de fleste MTV-organers websteder og kan hjælpe med at forklare, hvordan beslutningerne om nye lægemidler træffes.
Dossiererne undersøges nøje af MTV-organerne, enten direkte eller ved hjælp af akademiske samarbejdspartnere. Nogle MTV-organer foretager en uafhængig gennemgang af den kliniske og den økonomiske evidens for at undgå interessekonflikter.
MTV: bedømmelse
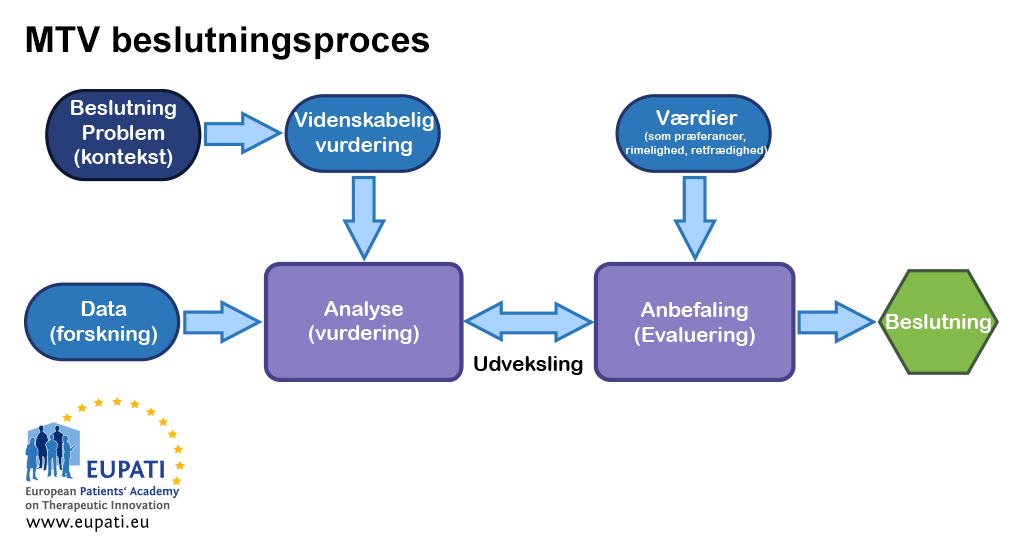
Da beslutningstagning om tilskud til en ny medicinsk teknologi kan være kontroversiel, er bedste praksis at adskille evidensvurderingen fra bedømmelsen og også fra beslutningstagningen. De organer, der foretager bedømmelsen, vil typisk basere deres anbefalinger på resultatet af evidensvurderingen og på yderligere input såsom lokale sundhedspolitikker, værdier og patientvidnesbyrd.
MTV-processerne resulterer generelt i en beslutning om, hvorvidt den nye teknologi skal på tilskudslisten i et sikringsbaseret system eller ej (listen omfatter lægemidler, der får tilskud fra den offentlige sygesikring), eller hvorvidt den anbefales til brug i et afgiftsbaseret nationalt sundhedssystem. Listen/anbefalingen kan gælde for lægemidlets anvendelse under begrænsede betingelser, f.eks. til en mindre patientpopulation med en mere alvorlig sygdom.
- Forskellige input er relevante på forskellige tidspunkter i MTV-beslutningsprocessen.
For at fastlægge, hvorvidt en intervention vil reducere hyppigheden af hjerteanfald, give væsentlige bivirkninger eller øge omkostningerne, er det nødvendigt at vurdere evidensens pålidelighed. Evidensen er altid forbundet med usikkerhed. Det er naturligvis i ethvert MTV-organs interesse at foretage en sund videnskabelig vurdering og bruge en konsekvent og gennemsigtig tilgang, der fører til forsvarlige beslutninger. I betragtning af MTV's tværfaglige karakter er det bl.a. nødvendigt med den bedste epidemiologiske, sociologiske, økonomiske, etiske og juridiske tilgang for at støtte de forskellige analyser.
For at træffe en beslutning er man dog nødt til at forstå, hvad samfundet og patienterne værdsætter. Er det en god ting at reducere hyppigheden af hjerteanfald? Og hvad må det koste?
Gode tilgange til bedømmelse involverer en lang række perspektiver og kan derfor ikke foretages tilfredsstillende af en enkelt person. Som følge heraf indkaldes der en komité, som benytter en klar og gennemsigtig proces til at nå frem til en anbefaling. Denne proces kaldes ofte for en deliberativ bedømmelse. De fleste MTV-organer lægger større vægt på omfanget af (og evidensens styrke for) forbedringer i patientrelevante helbredsresultater, der er observeret i veltilrettelagte kliniske forsøg med passende komparatorer.
Det næstvigtigste aspekt er ofte en eller flere økonomiske overvejelser. Næsten alle MTV-organer tager budgetindvirkningen i betragtning (det totale beløb, som brugen af det nye lægemiddel vil koste på sundhedssystemets budget i en bestemt periode). Budgetbeløbet skal være et nettobeløb, nemlig et beløb, hvor de besparelser er trukket fra, der kan opnås andre steder i sundhedssystemet som et resultat af fordelene ved det nye lægemiddel (f.eks. færre hospitalsindlæggelser som følge af alvorlige uønskede hændelser). Neutraliteten i komitéens sammensætning skal sikres – komitémedlemmerne skal med andre ord formelt erklære eventuelle mulige interessekonflikter eller afstå fra at deltage.
Nogle MTV-organer har vedtaget en etisk ramme, som giver deres anbefalinger mulighed for at blive gennemgået af en bredere gruppe interessenter. Dermed får virksomheder, klinikere eller patienter, som påvirkes uretmæssigt af en fejlagtig, partisk eller upræcis anbefaling, mulighed for at appellere den.
MTV-organerne beder i sjældne tilfælde om borgernes holdninger til udfordrende aspekter af beslutningstagningen, når de skal fastlægge prioriteringerne på sundhedsområdet. F.eks. har NICE i England et borgerråd, hvor en borgerjury fremsætter synspunkter af social værdi, der kan give input til NICE-bedømmelseskomitéerne. Nedenstående liste omfatter nogle af de spørgsmål, som borgerrådet har rådgivet om.
| År | Emne |
|---|---|
| 2002 | Klinisk behov |
| 2003 | Alder og omkostningseffektivitet |
| 2004 | Lægemidler til meget sjældne sygdomme og omkostningseffektivitet |
| 2005 | Obligatoriske folkesundhedsforanstaltninger |
| 2006 | Brug af "rule of rescue" |
| 2007 | Patientsikkerhed og omkostningseffektivitet |
| 2008 | Andre tilgange end ICER-tærsklen |
| 2009 | Innovation |
| 2010 | Forbedring af sundheden og finansielle incitamenter |
| 2011 | Udeladelse af omkostninger og fordele i overvejelserne |
| 2012 | Værdier for social omsorg |
I nogle tilfælde bliver MTV-resultaterne forbundet med prisforhandlinger. Forhandling om prisen er en metode, som regeringerne bruger til at give adgang til nye behandlinger (dvs. de finder en måde ikke at sige nej på). Andre muligheder er en begrænsning af, hvem der kan modtage behandlingen under tilskudsordningen.
Andet end anbefalinger
De, der kræver adgang til nye behandlinger, kan anse anbefalingerne om, hvorvidt et nyt lægemiddel bør gøres tilgængeligt inden for sundhedssystemet eller ej, for at være for strenge og ufleksible. Eftersom disse anbefalinger generelt er befolkningsfokuserede, giver de måske ikke mulighed for undtagelser på individuel basis. I stedet for en ja/nej-anbefaling kan der i forbindelse med MTV anvendes andre metoder, som kan være mere nyttige.
- Dækning ved evidensfremlæggelse (Coverage with evidence development; CED): Denne metode kan anvendes til at give adgang til et lovende, nyt lægemiddel, hvor der på nuværende tidspunkt er utilstrækkelige data til at underbygge enten den kliniske effektivitet eller omkostningseffektiviteten. Under disse omstændigheder kan MTV anbefale brugen af lægemidlet, under forudsætning af at der foretages en formel indsamling af evidens for at afklare disse usikkerheder, mens det anvendes, f.eks. i et register. Alternativt kan der være igangværende kliniske forsøg, som kræves af lægemiddelmyndighederne, og som vil give yderligere evidens på et tidspunkt i fremtiden.
- Prisfastlæggelse: Prisen på en medicinsk teknologi kan have en direkte effekt på udbydernes og patienternes adgang til denne teknologi. I nogle tilfælde kan betalerne forhandle med virksomheden om en pris, der er baseret på den medicinske teknologis oplevede værdi, navnlig når den medicinske teknologi er nyttig i nogle tilfælde, men ikke i alle. Denne tilgang sikrer, at de udbydere og patienter, der har brug for en bestemt teknologi, får adgang til den. MTV-organerne kan være involveret i denne proces, men er det ikke nødvendigvis. Værdibaseret prisfastlæggelse giver dog nogle udfordringer, da det er vanskeligt at sikre, at der tages tilstrækkeligt højde for alle aspekter af en medicinsk teknologis værdi. F.eks. viser resultaterne af kortvarige kliniske forsøg måske ikke de lægemiddelkarakteristika, der er værdifulde for patienterne, såsom bekvemme doseringsplaner eller mindre invasive indgivelsesmåder.
- Beslutningshjælp og kliniske retningslinjer: MTV kan angive, at lægemidlet har størst værdi, når det anvendes til en bestemt gruppe patienter eller i en bestemt rækkefølge efter andre behandlingsmuligheder. For at optimere værdien kan betaleren beslutte at give tilskud til lægemidlet i forbindelse med specifikke kliniske retningslinjer (for ordinerende læger) eller specifik beslutningshjælp (til patienter og klinikere). Beslutningshjælp er redskaber til patienter og læger, som hjælper dem med at bruge evidensen som informationsgrundlag for en individuel beslutning. De hjælper patienterne med at vælge mellem to behandlinger, der har forskellige risici og fordele. Det giver dem mulighed for at være bedre informeret, når de drøfter med deres læger, hvad de værdsætter mest, og for at bestemme, hvad deres bedste behandlingsmulighed er.1
- Prioritering i sundhedssystemet og budgetter: Der er udviklet metoder til bruge MTV-information til at bestemme, hvilke tjenester der bør betales for (f.eks. til at bestemme, hvilke tjenester der skal medtages i en universel sundhedsdækning). Dvs. hvordan den optimale blanding, som giver værdi, og som betaleren har råd til, er sat sammen.2
MTV-netværk
Mange MTV-organer i Europa er også forbundet med hinanden via European Union Network of HTA organisations (EUnetHTA), der blev oprettet i 2004. EUnetHTA arbejder tæt sammen med Europa-Kommissionen, Det Europæiske Lægemiddelagentur (EMA) og interessentorganisationer, der repræsenterer patienter/forbrugere, industrien, betalere (den offentlige sygesikring) og sundhedsudbydere. EUnetHTA arbejder på at udvikle metoder, standarder og processer for netværket for MTV i Europa (MTV-netværket).
MTV-netværket vil fremme gode MTV-praksisser og -metoder som svar på den store mangfoldighed i de europæiske MTV-metoder, -praksisser og -resultater og det omfattende dobbeltarbejde. Det tager også sigte på at fremme en effektiv brug af MTV-ressourcerne i Europa. De nøgleaktiviteter, som EUnetHTA udfører for MTV-netværket, omfatter udviklingen af retningslinjer for MTV-metodologi og styring af fælles vurderinger af relativ effektivitet. Disse aktiviteter vil være med til at reducere arbejdsbyrden på nationalt plan og gøre det lettere for MTV-organerne på medlemsstatsplan at foretage yderligere analyser og beslutningstagning, som er specifik for deres sundhedssystem.
Flere ressourcer
- Health Technology Assessment Network. Retrieved 6 January, 2016, from https://ec.europa.eu/health/technology_assessment/policy/network
- EUnetHTA: http://www.eunethta.eu/ (Retrieved 6 January, 2016)
- Opportunities for patients to be involved with EUnetHTA: http://www.eunethta.eu/ (Retrieved 6 January, 2016).
- Sorenson, C., Drummond, M., and Panos, K. (2008). Ensuring value for money in health care: The role of health technology assessment in the European Union. Copenhagen: World Health Organization. Retrieved 6 January, 2016, from http://www.euro.who.int/__data/assets/pdf_file/0011/98291/E91271.pdf
- Velasco Garrido, M., Kristensen, F.B., Nielsen, C.P, and Busse, R. (2008). Health technology assessment and health policy-making in Europe: Current status, challenges and potential. Copenhagen: World Health Organization. Retrieved 6 January, 2016, from http://www.euro.who.int/__data/assets/pdf_file/0003/90426/E91922.pdf
- Kleinjen, S., George, E., Goulden, S., et al. (2012). ‘Relative effectiveness assessment of pharmaceuticals: similarities and differences in 29 jurisdictions’. Value Health, (15), 954-960. Retrieved 6 January, 2016, from http://www.valueinhealthjournal.com/article/S1098-3015(12)01609-9/pdf
- Rawlins, M. (2014). ‘Evidence, values, and decision-making.’ International Journal of Technology Assessment in Health Care, (30), 233-238.
Referencer
- Ottawa Hospital Research Institute (2014). Patient Decision Aids: Implementation Toolkit. Retrieved 6 January, 2016, from http://decisionaid.ohri.ca/implement.html
- Bandolier (2007). Programme budgeting and marginal analysis. Retrieved 6 January, 2016, from http://www.bandolier.org.uk/booth/glossary/PBMA.html
A2-6.05-v1.1