Médicament pédiatrique : plan d’investigation pédiatrique
Introduction
Le développement normal d’un médicament exige la réalisation de différentes études permettant de garantir sa qualité, son innocuité et son efficacité. Ces études exigent à leur tour des procédures de planification rigoureuses afin de s’assurer de leur validité, autant sur le plan éthique que scientifique. Pendant le processus de développement, un plan d’investigation pédiatrique est élaboré afin de garantir que les données nécessaires à l’usage d’un médicament sur des enfants sont obtenues lorsque cela peut être réalisé sans danger.
Plan d’investigation pédiatrique (PIP)
L’objectif d’un PIP est de soutenir l’autorisation pédiatrique d’un médicament. Une fois un PIP accepté, il est maintenu à jour au moyen d’une procédure de modification.
Un PIP contient les éléments suivants indiqués ci-dessous.
- Les besoins de tous les groupes d’âges pédiatriques, de la naissance à l’adolescence, et le calendrier des études sur les enfants par rapport à celles sur les adultes. L’éventail complet des âges pédiatriques doit être couvert, sauf justification contraire.
- Une présentation de la maladie, de son diagnostic et du traitement. Toute différence entre enfants et adultes doit être mise en évidence.
- Une présentation des données disponibles sur le médicament, y compris :
- les informations chimiques sur la formulation actuelle ;
- les données d’études cliniques et non cliniques.
- La stratégie proposée comporte une partie ou la totalité des aspects suivants :
- une description de toute étude non clinique supplémentaire ;
- des suggestions de formulation pédiatrique (le cas échéant), y compris des mesures pour adapter la formulation du médicament afin de rendre son utilisation plus acceptable chez les enfants, comme par l’exemple l’utilisation d’une formulation liquide plutôt que de gros comprimés.
- Une description des essais cliniques prévus ou des modélisations/simulations envisagées (usage d’ordinateurs pour prévoir le mode d’action du médicament en usage pédiatrique), y compris :
- les détails du calendrier des études chez les enfants, par rapport au plan de développement chez les adultes ;
- si les études pédiatriques ne sont pas effectuées en parallèle, un report peut être demandé pour l’achèvement du PIP.
Le PIP est envoyé par le demandeur au Comité pédiatrique (PDCO). La loi exige que le PIP soit déposé avant la fin des études pharmacocinétiques chez les adultes. Le PIP est normalement soumis après une expérience clinique sur des adultes. Si un PIP est effectué et que les données pédiatriques sont incluses dans les informations produit pour l’UE, une extension de six mois du Certificat complémentaire de protection (CCP) est octroyée en récompense.
Le Comité pédiatrique de l’EMA (PDCO)
Le Comité pédiatrique (PDCO) évalue le contenu d’un PIP, traite toutes les demandes de dérogations et de reports, et fournit une analyse et une critique d’experts afin d’adopter une « opinion » permettant de déterminer si le PIP est acceptable ou non. Le PDCO inclut des représentants des patients.
Sur demande, ce comité évaluera les données générées après l’accord octroyé à un PIP. Il maintient également :
- une liste des produits ou classes de médicaments pour des dérogations ;
- un inventaire à jour des besoins pédiatriques établi par le biais des données recueillies.
Ce comité utilise ces informations pour conseiller les réseaux de recherche pédiatrique européens sur les maladies à étudier et sur les formulations pédiatriques de médicaments existants qui seraient les bienvenues.
La législation européenne est constamment remaniée et révisée, ce qui permet d’optimiser le processus d’acheminement des médicaments jusqu’aux patients. L’avis de tous les intervenants est sollicité, y compris médecins, professionnels de la santé, compagnies pharmaceutiques, patients et organisations de patients.
Présentation de la procédure PIP
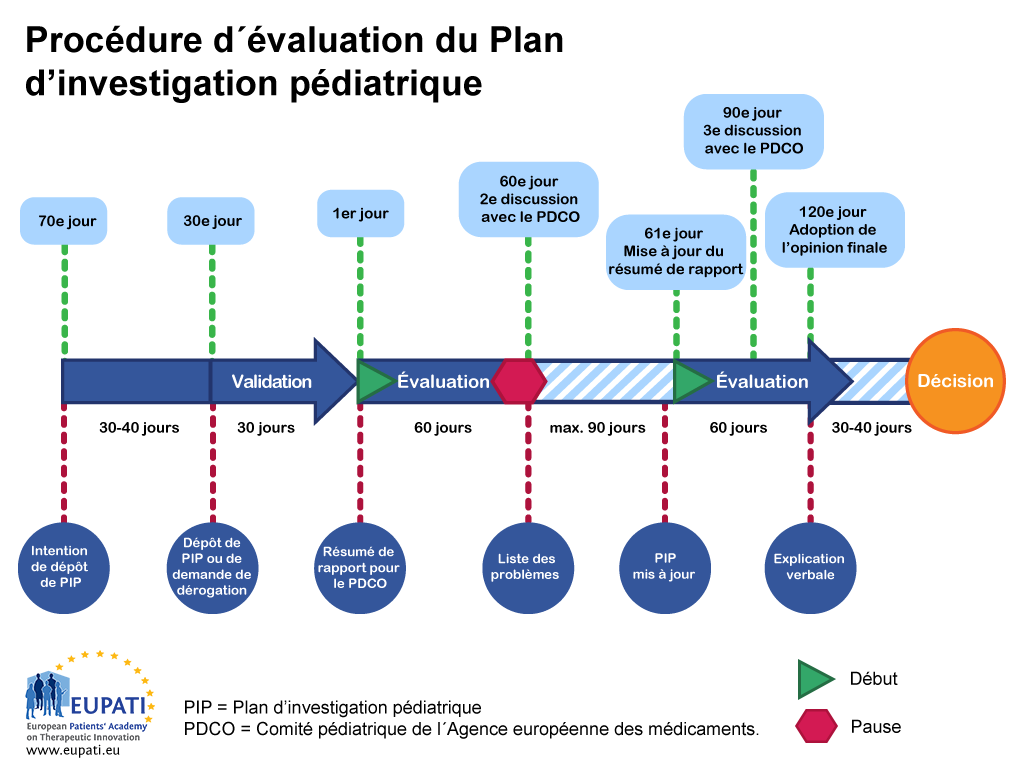
- Un Plan d’investigation pédiatrique est évalué par le Comité pédiatrique de l’Agence européenne des médicaments et suit une procédure bien déterminée avec des délais définis.
La procédure PIP prend 9 à 10 mois, du moment de la soumission à celui de la décision. Lorsque le demandeur produit une intention de déposer un PIP, le PDCO nomme un « rapporteur » pour diriger l’évaluation et un « pair examinateur » pour vérifier la qualité de l’évaluation à l’intérieur même du comité. Le rapporteur et l’examinateur vérifient le PIP initial et présentent leurs conclusions au PDCO.
Ce processus d’examen prend la forme d’une procédure de 120 jours. Néanmoins, une pause (suspension connue sous le nom de « clock stop ») survient à 60 jours pour permettre au PDCO de poser des questions au demandeur. Ces pauses sont normalement de trois mois au maximum, même si leur durée fait l’objet d’un accord au cas par cas avec le PDCO.
Lorsque les réponses du demandeur ont été obtenues, le décompte reprend au 61e jour et la procédure se poursuit sans pause jusqu’à la fin, c’est-à-dire jusqu’au 120e jour. Cela signifie que toute question supplémentaire devra recevoir une réponse pendant le déroulement de la procédure. Si des questions restent sans réponse après la troisième discussion avec le PDCO, ce dernier ou le demandeur peuvent demander une explication verbale. Ceci permet au demandeur de parler directement au comité tout entier.
Dérogations de PIP
Il se peut qu’une dérogation de soumission de PIP soit accordée à un demandeur dans les cas suivants :
- il est vraisemblable que le médicament soit inefficace ou dangereux pour les enfants ;
- la maladie ou le problème concernent uniquement des adultes ; ou
- aucun « avantage thérapeutique considérable » n’a été observé, ou il existe une justification selon laquelle des problèmes de faisabilité empêchent de démontrer un avantage thérapeutique considérable.
Trois types de dérogations sont disponibles :
- Dérogation de classe – conformément à une liste émise par le PDCO des problèmes affectant uniquement les adultes. Le PDCO considère simultanément le retrait de toutes les dérogations de classes (surtout pour les cancers).
- Dérogation complète – pour tous les sous-ensembles pédiatriques et toutes les indications.
- Dérogation partielle – pour un sous-ensemble pédiatrique ou plusieurs, et une indication ou plusieurs.
Il est possible de réviser et de modifier une dérogation. En cas de révocation d’une dérogation, l’exigence de soumission des données conformément à un PIP déjà adopté ne s’appliquera pas pendant 36 mois.
Ressources complémentaires
- Pour plus de détails sur les rôles du PDCO, vous pouvez consulter : Agence européenne des médicaments (2010). Roles and responsibilities of members and alternates, rapporteur and peer reviewers, experts and observers of the Paediatric Committee (PDCO). Consulté le 25 août 2015 sur http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Pour plus de détails sur le PDCO, vous pouvez consulter : Agence européenne des médicaments (2015). PDCO: Overview. Consulté le 25 août 2015 sur http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Pour les questions les plus fréquentes sur la procédure PIP, vous pouvez consulter : Agence européenne des médicaments (2014). Questions and answers on the procedure of PIP compliance verification at EMA, and on paediatric rewards. Consulté le 25 août 2015 sur http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1