Kliniske forsøgsresultater: Offentliggørelse
Introduktion
Kliniske forsøg gør nye lægemidler og forbedrede behandlinger tilgængelige for patienter. Den information, som kliniske forsøg giver om disse behandlingers virkning og sikkerhed, er vigtig for, at patienterne og deres læger kan træffe informerede beslutninger om behandlingen. En behandlings nytte skal vurderes samlet, idet alle tilgængelige resultater fra kliniske forsøg, hvor behandlingen undersøges, tages i betragtning. Adgang til information om kliniske forsøg er en vigtig måde at forbedre forskningens effektivitet på, da man reducerer dobbeltarbejde og gentagelser i forskningsindsatsen. Gennemsigtigheden i den kliniske forsøgsinformation er vigtig for at sikre tilliden til de kliniske forsøgsresultater. Læseren skal foretage en kritisk gennemgang af den information, der er offentliggjort om kliniske forsøg.
Hvad er kliniske forsøgsresultater?
Resultaterne af en klinisk undersøgelse eller et klinisk forsøg er alle de data, målinger og statistiske analyser, der genereres under denne kliniske undersøgelse.
Forsøgsresultaterne omfatter følgende elementer:
- Beskrivelse af forsøgspopulationen: Antal deltagere pr. forsøgsbehandlingsarm, som påbegyndte, fuldførte og udgik af forsøget.
- Baselinedata: Data, der indsamles i starten af et klinisk forsøg. Disse data omfatter: demografiske oplysninger (såsom alder og køn), patientkarakteristika (såsom vægt, højde, blodtryk osv.) og forsøgsspecifikke målinger (såsom sygdomskarakteristika eller tidligere behandling).
- Målinger af behandlingens effekt på deltagerne: f.eks. lægemidlets virkning i et fase II-forsøg, patientoverlevelse og/eller livskvalitet i et fase III-forsøg.
- Uønskede hændelser hos forsøgsdeltagerne: f.eks. smerter, kvalme og andre bivirkninger.
Den kliniske forsøgsrapport (CSR) er det formelle dokument, der beskriver resultaterne af et klinisk forsøg og giver evidens for brugen hos mennesker. CSR’er følger et format, der er fastlagt af lægemiddelmyndighederne. En CSR udarbejdes af forsøgets sponsor og udgør en del af det fælles tekniske dokument (CTD). På grund af fortrolighedsspørgsmål og kommercielle spørgsmål er adgangen til kliniske forsøgsrapporter sædvanligvis begrænset til sponsor og de lægemiddelmyndigheder, som behandler en ansøgning om markedsføringstilladelse (MAA).
Offentliggørelse af kliniske forsøgsresultater
Når det kliniske forsøg og analysen heraf er afsluttet, kan forskerne præsentere deres konklusioner på videnskabelige møder og i medicinske tidsskrifter. Inden offentliggørelsen i medicinske tidsskrifter bliver manuskriptet fagfællebedømt af uafhængige eksperter, som er udpeget af tidsskriftets redaktør.
Publikationerne skal indeholde tilstrækkeligt med detaljer til, at læseren kan danne sig sin egen mening om undersøgelsens resultater. Publikationens kvalitet har indflydelse på den tillid, som læseren har til resultaternes validitet. Derfor er der forskellige retningslinjer og tjeklister tilgængelige for rapporteringen af resultaterne, så det sker på en standardiseret måde, alt efter hvilken type forskning der er tale om.
Forskellige organisationer er i øjeblikket i gang med initiativer for at fremme eller kræve registrering og offentliggørelse af klinisk forsøgsinformation. I Europa indsamler EudraCT, EU’s database vedrørende kliniske forsøg, som hører under Det Europæiske Lægemiddelagentur (EMA), information om alle kliniske forsøg med lægemidler, der udføres i Europa. Siden juli 2014 har denne database også gjort sammendrag af forsøgsresultaterne tilgængelige for offentligheden. Det er obligatorisk at offentliggøre resultaterne af forsøg, der finder sted i EU og er startet efter den 1. januar 2015 – uanset om resultaterne er negative eller positive. Verdenssundhedsorganisationen (WHO) sætter via sin internationale registerplatform for kliniske forsøg (ICTRP) internationale standarder for registrering og rapportering af alle kliniske forsøg. I USA er der en lignende tilgang i registeret clinicaltrials.gov.
Evidensniveauer i kliniske forsøgsresultater
Beslutninger om medicinsk behandling bygger nu i vid udstrækning på evidensbaseret medicin (EBM). EBM kombinerer klinisk erfaring med den nuværende bedste evidens fra kontrollerede undersøgelser og forskning for at give patienten den bedste behandling. Information om behandlingens sikkerhed og virkning er vigtig i EBM, så patienterne og deres læger kan træffe informerede beslutninger om behandling.
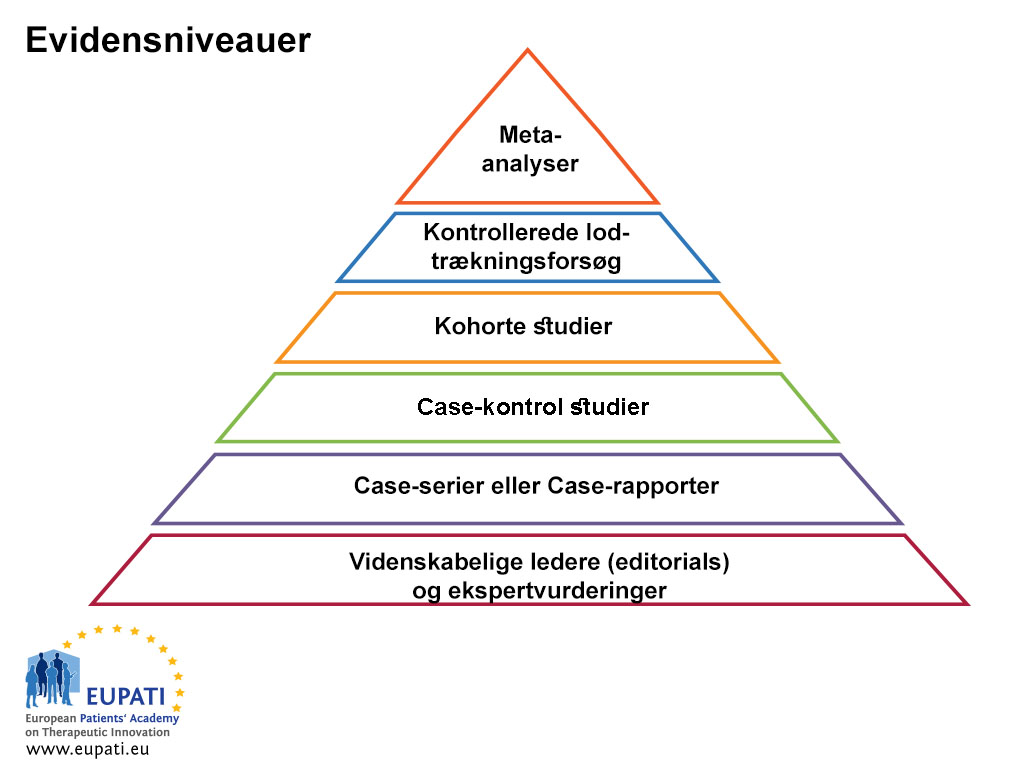
EBM bygger på viden og gennemgang af den nuværende bedste evidens om effekten af forskellige former for behandling og sundhedspleje generelt. Det er vigtigt, at man ikke begrænser søgningen efter evidens for en behandling til en enkelt publikation. Når man sammenligner resultaterne fra forskellige kilder, er det vigtigt at huske, at der er forskellige evidensniveauer (se figur 1 nedenfor). Evidensniveauerne repræsenterer og klassificerer undersøgelsens kvalitet og dermed styrken af den evidens, som undersøgelsen giver. Randomiserede, kontrollerede og blindede undersøgelser giver den bedste videnskabelige evidens for fordele og risici, men er ikke altid tilgængelige. En metaanalyse, som er en statistikbaseret gennemgang, der sammenligner og kombinerer resultaterne af forskellige, men relaterede undersøgelser, tager sigte på at identificere mønstre, uoverensstemmelser og andre forhold på tværs af flere undersøgelser. En metaanalyse kan støtte en stærkere konklusion end nogen individuel undersøgelse, men den kan være fejlbehæftet på grund af publikationsbias.
- Evidensniveauer er nyttige når man skal vurdere kvaliteten af evidens.
Undersøgelsestyperne omfatter generelt:
- Randomiserede forsøg af høj kvalitet med tilstrækkeligt mange forsøgsdeltagere eller metaanalyser af randomiserede forsøg, der viser statistisk konsekvente resultater
- Randomiserede forsøg, som har et utilstrækkeligt antal forsøgsdeltagere og evt. er kendetegnet af bias, eller som viser statistisk inkonsekvente resultater
- Ikke-randomiserede undersøgelser med samtidig kontrol
- Ikke-randomiserede undersøgelser med historisk kontrol (f.eks. en typisk enkeltarmet fase II-undersøgelse)
- Ekspertudvalgsgennemgang, case-rapporter, retrospektive undersøgelser
Fejlkilder i publikationer
De tre mest almindelige kildefejl i publikationerne er:1
- Risikoen for misbrug og misrepræsentation af statistiske test og deres resultater på grund af forvirring omkring tallenes betydning (estimater) og fortolkningen af hypotesetest (p-værdier og styrke).
- "Data dredging" (datafiskeri) eller test af et stort antal hypoteser i et enkelt datasæt for at finde en positiv effekt. Når en lang række hypoteser testes med et enkelt datasæt, er det næsten sikkert, at nogle af hypoteserne fejlagtigt vil synes statistiske signifikante, selv om korrelationerne måske ikke eksisterer i virkeligheden. Hvis forskere, der anvender dataudvindingsteknikker, ikke er forsigtige, kan de let blive vildledt af disse tilsyneladende signifikante resultater.
- Bias. Man taler om bias i forskning, når en systematisk fejl indføres i stikprøvetagning af data eller hypoteseafprøvning ved at vælge eller foretrække det ene udfald eller svar frem for det andet. Bias er ikke altid et resultat af bevidste handlinger – det kan også indføres utilsigtet.
Referencer
- Goldacre, B. (2010) Bad science: Quacks, hacks, and big pharma flacks. New York: Faber and Faber.
- Rennie, D., & Guyatt, G. (2002). Users' guides to the medical literature: A manual for evidence-based clinical practice. Chicago, IL: American Medical Association.
A2-4.35.1-v1.2