klinische Studienergebnisse: Veröffentlichung
Einleitung
klinische Prüfungen ermöglichen neue Arzneimittel und verbesserte Behandlungsmöglichkeiten für Patienten. Die Informationen, die klinische Prüfungen über die Wirksamkeit und Sicherheit dieser Behandlungen generieren, sind wichtig für Patienten und ihre Ärzte, um fundierte Behandlungsentscheidungen zu treffen. Der Nutzen der Behandlung muss umfassend beurteilt werden, unter Berücksichtigung aller aus klinischen Studien mit dieser Behandlung zur Verfügung stehenden Ergebnisse. Zugang zu Informationen über klinische Prüfungen ist ein wichtiges Mittel zur Verbesserung der Effizienz in der Forschung durch weniger Verdoppelung oder Wiederholung von Forschungsanstrengungen. Die Transparenz der Informationen aus klinischen Prüfungen ist bei der Gewährleistung des Vertrauens in die klinischen Studienergebnisse wichtig. Der Leser muss über klinische Prüfungen veröffentlichten Informationen kritisch überprüfen.
Was sind klinische Studienergebnisse?
Die Ergebnisse einer klinischen Studie oder Prüfung umfassen alle Daten, Messungen und statistischen Auswertungen, die im Rahmen dieser klinischen Studie erfolgen.
Zu den Studienergebnissen gehören folgende Punkte:
- Beschreibung der Studiengruppe Die Anzahl der Teilnehmer pro Behandlungsarm, die die Studie begonnen, abgeschlossen oder vorzeitig abgebrochen haben.
- Ausgangsdaten: Zu Beginn einer klinischen Studie erfasste Daten. Dazu gehören: Demografie (wie etwa Alter, Geschlecht), Patienteneigenschaften (wie etwa Gewicht, Größe, Blutdruck, usw.), und studienspezifische Messungen (wie Krankheitsmerkmale oder vorherige Behandlung).
- Messungen, die die Wirkung der Behandlung auf die Teilnehmer erfassen. Zum Beispiel die Aktivität eines Arzneimittels in einer Phase II-Studie, Überleben des Patienten, und/oder Lebensqualität in Phase III-Studien.
- Bei den Studienteilnehmern aufgetretene unerwünschte Ereignisse: Zum Beispiel Schmerzen, Übelkeit, und sonstige Nebenwirkungen.
Der klinische Studienbericht (Clinical Study Report, CSR) ist das offizielle Dokument, in dem die Ergebnisse einer klinischen Studie beschrieben werden, und das den Beweis für den Nutzen der Studie am Menschen liefert. CSRs folgen einem von den Zulassungsbehörden bestimmten Format. Der CSR wird vom Sponsor der Studie verfasst und bildet einen Teil des standardisierten Antrags auf Zulassung eines Arzneimittels (Common Technical Document, CTD). Aus Vertraulichkeits- und wirtschaftlichen Gründen ist der Zugriff auf den CSR üblicherweise dem Sponsor und den Regulierungsbehörden, die einen Antrag auf Marktzulassung beurteilen, vorbehalten.
Veröffentlichung von klinischen Studienergebnissen
Am Ende der klinischen Studie und ihrer Analyse können Wissenschaftler ihre Schlussfolgerungen auf wissenschaftlichen Tagungen und in medizinischen Fachzeitschriften präsentieren. Vor der Veröffentlichung in medizinischen Fachzeitschriften wird der Text von unabhängigen Experten, die vom Herausgeber der Zeitschrift ernannt werden, begutachtet.
Veröffentlichungen sollten ausreichende Details enthalten, um dem Leser ein eigenes Urteil über die Ergebnisse der Studie zu ermöglichen. Das Vertrauen, das ein Leser in die Aussagekraft der Ergebnisse hat, wird durch die Qualität der Veröffentlichung beeinflusst. Daher stehen verschiedene Leitfäden und Checklisten zur Verfügung, um die Berichterstattung über die Ergebnisse in standardisierter Form zu führen, je nach Art der Forschung, die durchgeführt wird.
Verschiedene Organisationen engagieren sich derzeit in Initiativen, die Registrierung und Offenlegung von Informationen über klinische Prüfungen zu fördern oder zu verlangen. In Europa sammelt die EudraCT, die European Clinical Trials Database der Europäischen Arzneimittel-Agentur (EMA) Informationen zu allen in Europa durchgeführten klinischen Prüfungen mit Arzneimitteln. Seit Juli 2014 macht diese Datenbank auch die Zusammenfassungen von Studienergebnissen der Öffentlichkeit zugänglich. Für Studien, die nach dem 1. Januar 2015 in der EU begonnen wurden, müssen all diese Ergebnisse veröffentlicht werden, ungeachtet dessen, ob sie positiv oder negativ sind. Die Weltgesundheitsorganisation (WHO) setzt durch ihre International Clinical Trials Registry Platform (ICTRP) internationale Standards zur Registrierung und Berichterstattung für alle klinischen Prüfungen. In den Vereinigten Staaten leistet der Register clinicaltrials.gov Ähnliches.
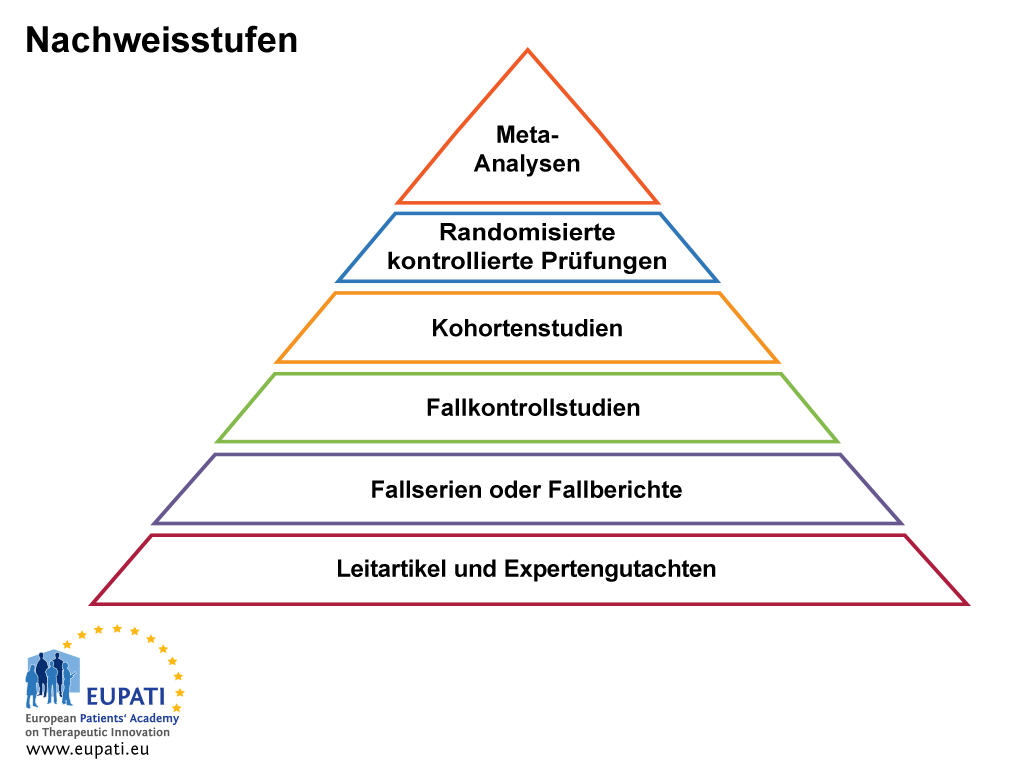
Nachweisstufen in klinischen Studienergebnissen
Medizinische Behandlungsentscheidungen werden heute weitgehend auf evidenzbasierter Medizin (EBM) begründet. Die EBM kombiniert klinische Erfahrung mit den aktuell best-belegten Ergebnissen aus kontrollierten Studien und Forschungsarbeiten, um dem Patienten die beste Behandlung zu bieten. Informationen über Sicherheit und Wirksamkeit dieser Behandlungen sind wichtig in der EBM, damit Patienten und ihre Ärzte fundierte Behandlungsentscheidungen treffen können.
Die EBM verlässt sich auf Erkenntnisse und die Überprüfung der derzeit best-belegten Ergebnisse hinsichtlich der Wirkung verschiedener Behandlungsformen und der Gesundheitspflege im Allgemeinen. Es ist wichtig, die Suche nach Beweisen zu einer Behandlung nicht auf eine einzige Veröffentlichung zu begrenzen. Beim Vergleich der Ergebnisse aus verschiedenen Quellen ist es wichtig, zu beachten, dass es verschiedene Nachweisstufen gibt (siehe Abbildung 1 unten). Nachweisstufen repräsentieren und klassifizieren die Qualität der Studie und damit die Stärke der Beweise, die die Studie liefert. Randomisierte, kontrollierte, verblindete Studien liefern den besten wissenschaftlichen Beweis für Nutzen und Risiko, sind jedoch nicht immer verfügbar. Eine Meta-Analyse, eine auf Statistik beruhende Zusammenfassung und Gegenüberstellung von Ergebnissen aus verschiedenen aber miteinander vergleichbaren Studien zielt darauf ab, Muster, Unstimmigkeiten und andere Beziehungen über mehrere Studien hinweg zu erkennen. Eine Metaanalyse kann eine stärkere Schlussfolgerung als jede einzelne Studie liefern, kann aber wegen der Publikationsverzerrung fehlerhaft sein.
- Nachweisstufen sind nützlich bei der Bewertung der Qualität einer Evidenz.
Grundsätzlich gibt es folgende Arten von Studien:
- Ausreichend große, qualitativ hochwertige randomisierte Prüfung oder Meta-Analyse von randomisierten Prüfungen, die statistisch widerspruchsfreie Ergebnisse zeigt
- Randomisierte, unzureichend große Studien, möglicherweise verzerrt, oder mit statistisch widersprüchlichen Ergebnissen
- Nicht-randomisierte Studien mit gleichzeitigen Kontrollen
- Nicht-randomisierte Studien mit historischen Kontrollen (zum Beispiel eine typische einarmige Phase-II-Studie)
- Übersicht von einem Expertengremium, Fallberichte, retrospektive Studien
Fehlerquellen in Veröffentlichungen
Die drei häufigsten Fehlerquellen in Veröffentlichungen sind:1
- Das Risiko des Missbrauchs und der Fehlinterpretation von statistischen Tests und ihrer Ergebnisse, auf Grund der Verwirrung über die Bedeutung der Zahlen(Schätzungen) und der Interpretation von Hypothesentests (Annahmentests) (p-Werte, Power).
- Datenfischen oder Testen einer großen Anzahl von Hypothesen in einem einzigen Datensatz bei der Suche nach einem positiven Effekt. Wenn zahlreiche Hypothesen mit einem einzigen Datensatz getestet werden, ist es so gut wie sicher, dass einige Hypothesen fälschlicherweise statistisch signifikant erscheinen, auch wenn es die Zusammenhänge in Wirklichkeit gar nicht gibt. Wenn Forscher mit systematischen Datensuche-Techniken nicht vorsichtig umgehen, können sie leicht von diesen scheinbar signifikanten Ergebnissen in die Irre geführt werden.
- Verzerrung. In der Forschung tritt eine Verzerrung auf, wenn durch Auswahl oder Bevorzugung eines Ergebnisses oder einer Antwort anderen gegenüber systematische Fehler in die Daten-Sammlung oder in die Hypothesentests gelangen. Eine Verzerrung ist nicht immer das Ergebnis absichtlicher Handlungen – sie kann auch unabsichtlich eingeführt werden.
Quellenangaben
- Goldacre, B. (2010) Bad science: Quacks, hacks, and big pharma flacks. New York: Faber and Faber.
- Rennie, D., & Guyatt, G. (2002). Users' guides to the medical literature: A manual for evidence-based clinical practice. Chicago, IL: American Medical Association.
A2-4.35.1-v1.2