HTA-Systeme in Europa:
Einleitung
Health Technology Assessment (HTA) ist ein multidisziplinärer Prozess, bei dem Informationen über medizinische, soziale, wirtschaftliche und ethische Fragen im Zusammenhang mit der Verwendung einer Gesundheitstechnologie systematisch, transparent, unvoreingenommen und auf robuste Art und Weise zusammengefasst werden. Das Ziel besteht darin, die Ausformulierung einer patientenorientierten, sicheren und wirksamen Gesundheitspolitik zu fördern, die versucht, beste Werte zu erreichen. Trotz seiner politischen Ziele muss der HTA immer fest in der Forschung und der wissenschaftlichen Methode verwurzelt sein.
Betrachtet man die HTA im Bereich der Arzneimittel, ist es hilfreich, zu wissen, wie Arzneimittel zugelassen werden und ein Grundverständnis des Lebenszyklus eines Produktes und der Prozesse, die zu einer Genehmigung für das Inverkehrbringen (MA) führen, zu haben. Ebenso von Vorteil ist, zu wissen, wie die HTA je nach Land bei Erstattungs- oder Versicherungsschutzsystemen eingesetzt wird. Das Pharmaunternehmen muss qualitativ hochwertige, randomisierte klinische Studien durchführen und Antragsunterlagen bei einer entsprechenden Zulassungsbehörde einreichen. Sobald einem Produkt die Marktzulassung basierend auf Sicherheit, Qualität und Wirksamkeit erteilt wurde, kann es in Verkehr gebracht (verkauft) werden. Um Patienten einen breiten Zugang zu notwendigen Therapien zu gewährleisten, ist es oft notwendig, dass das Produkt von einem nationalen Gesundheitssystem oder Versicherer gedeckt ist. Dies würde bedeuten, dass das Produkt im jeweiligen Land in die Liste der erstattungsfähigen Arzneimittel aufgenommen oder vom Versicherungsschutz gedeckt wird.
Gleichzeitig müssen diese institutionellen Kostenträger den Zugang zu innovativen Behandlungsmethoden innerhalb eines begrenzten Budgets verwalten. Aufgrund dieser Einschränkungen wollen Kostenträger sicherstellen, dass sie für neue Technologien zahlen, die echte Verbesserungen der Behandlungsergebnisse bieten. Genau hier kommt die HTA ins Spiel, zumal es ihre grundlegende Rolle ist, den therapeutischen Mehrwert (in Bezug auf die gesundheitlichen Folgen für die Patienten) einer neuen Technologie im Vergleich zu den aktuellen Pflegestandards zu bestimmen.
Ein guter Ausgangspunkt ist, zu verstehen, welche Organisationen die Hauptakteure in diesem Prozess sind. In Europa gibt es verschiedene Stellen, die sowohl für pharmazeutische als auch für nicht-pharmazeutische Gesundheitstechnologiebewertung (HTA) verantwortlich sind. Struktur, Funktion, Aufgabenbereich und Ansätze dieser Einrichtungen variieren je nach den verschiedenen Gesundheitssystemen und politischen Strukturen, in denen sie agieren.
Einige Beispiele für HTA-Gremien in Europa, die pharmazeutische Bewertungen durchführen:
- Frankreich – Haute Autorité de Santé (HAS) – http://www.has-sante.fr
- Deutschland – Gemeinsamer Bundesausschuss (GBA) – https://www.g-ba.de/
- Schottland – Scottish Medicines Consortium (SMC) – scottishmedicines.org.uk/Home
- Schweden – Tåndvards Och Läkemedelsförmänsverket (TLV) – tlv.se/In-English/in-english/
Bitte beachten Sie, dass in Deutschland die Bewertungskomponente der HTA vom IQWIG (Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen) durchgeführt wird, während der GBA für die Beurteilungskomponente und die Entscheidungsfindung zuständig ist. Beachten Sie auch, dass das HTA-Gremium in einigen europäischen Ländern auch Bewertungen von nicht-pharmakologischen Interventionen wie etwa Geräten, chirurgischen Eingriffen und (in manchen Fällen) Maßnahmen im Gesundheitswesen durchführt. Dazu gehören:
- Norwegen – NOKC (The Norwegian Knowledge Centre, Nasjonalt kunnskapssenter for helsetjenesten) – https://www.fhi.no/en/
- Schweden – SBU ( Swedish Agency for Health Technology Assessment and Assessment of Social Services) – http://www.sbu.se/en/
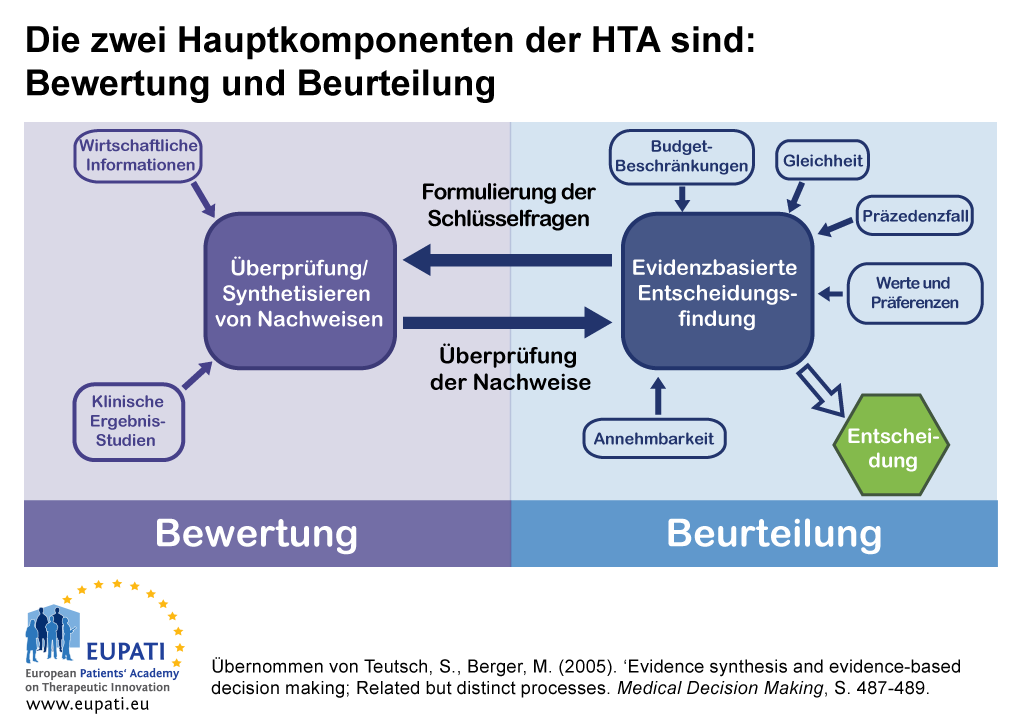
Die HTA besteht aus zwei Hauptkomponenten: Bewertung und Beurteilung.
- Die wechselseitige Beziehung zwischen Bewertung und Beurteilung liefert die Grundlage der Entscheidungsfindung bei der Bewertung von Gesundheitstechnologien (HTA).
In einigen Ländern können die Bewertungs- und Beurteilungsfunktionen einer HTA von getrennten Gremien ausgeübt werden.
- Ein Gremium kann eine Bewertungsfunktion übernehmen, indem es Erkenntnisse zusammenfasst oder vorgelegte Beweise kritisch überprüft.
- Ein anderes Gremium kann eine beurteilende Tätigkeit ausüben, indem es die Bewertung im Lichte weiterer, auf den lokalen Kontext bezogener Faktoren berücksichtigt. Die Gremien bieten dann Beratung an oder geben Empfehlungen ab.
HTA: Bewertung
Am Beginn eines arzneimittelbezogenen HTA-Verfahrens steht in der Regel ein Unternehmen, welches ein Dossier von relevanten Informationen bei einem HTA-Gremium einreicht. Im Falle von nicht arzneimittelbezogenen Interventionen führen HTA-Gremien in der Regel eine systematische Überprüfung der veröffentlichten Informationen durch. Standardmäßig enthält das Dossier detaillierte Beweise in Bezug auf die Sicherheit und Wirksamkeit der neuen Technologie sowie den „zusätzlichen klinischen Nutzen” – mit anderen Worten, einen Vergleich der klinischen Wirksamkeit des neuen Produkts mit der bestehenden Standardtherapie (dem Vergleichspräparat).
Manche HTA-Systeme in Europa nehmen auch eine Einschätzung der Auswirkungen, die das neue Produkt möglicherweise auf das Budget des Gesundheitssystems (eine Bewertung der Budgetauswirkungen) hat, oder der Wirksamkeit des Arzneimittels im Vergleich zu seinen Kosten für das System (z.B. eine Kostenwirksamkeitsanalyse oder wirtschaftliche Auswertung) vor. Nicht alle HTA-Systeme in Europa messen der vergleichenden Kosten-Nutzen-Analyse die gleiche Bedeutung bei, aber alle konzentrieren sich auf den zusätzlichen klinischen Nutzen.
Die gängigsten Bestandteile eines Antragsdossiers oder einer „Einreichung” sind nachfolgend aufgeführt: bitte beachten Sie, dass einige dieser Komponenten stärker quantitativ sind, als andere. Gerechtigkeits- und rechtliche Aspekte sowie jene der öffentlichen Gesundheit können stärker qualitativ und daher möglicherweise im Beurteilungs- anstatt dem Bewertungsteil der HTA enthalten sein.
- Zielpopulation von Patienten: Jene spezifische Population, die es bei der Kostenübernahme zu berücksichtigen gilt (wird von der voll zugelassenen Indikation oder deren Untergruppe bestimmt).
- Krankheitsbelastung: Auch als „medizinischer Handlungsbedarf” oder „Therapiebedarf” bekannt. Dies kann ein Maß für die Anzahl der von einer bestimmten Krankheit betroffenen Menschen sein, für die die gegenwärtig verfügbaren Therapien nicht geeignet sind. Dazu können die Anzahl neuer Diagnosen einer Krankheit, oder die Kosten für die Gesellschaft oder eine Regierung, die die Betroffenen vertritt, gehören. Es können auch weitere qualitative Aspekte der Krankheitsbelastung, sowie den Patienten derzeit zur Verfügung stehende Behandlungen berücksichtigt werden.
- Beschreibung des Arzneimittels: Eine Beschreibung des Arzneimittels, seiner Funktionsweise, der Darreichungsform (z.B. Spritze, Tablette), wo es dem Patienten verabreicht wird, (z.B. im Krankenhaus, in der Gemeinde, der Grundversorgung, zu Hause), wie oft, und seine entsprechende Verwendung in der Therapie zusammen mit anderen Interventionen und Arzneimitteln.
- Klinische Wirksamkeit: In der Medizin bedeutet klinische Wirksamkeit eine positive therapeutische Wirkung. Wenn die Wirksamkeit nachgewiesen ist, ist der Eingriff aller Voraussicht nach mindestens gleich gut wie andere verfügbare Eingriffe, mit denen er verglichen wurde.Im Gegensatz zur Alltagswirksamkeit gibt die klinische Wirksamkeit an, wie gut eine Behandlungsform in klinischen oder Laborstudien funktioniert. Die Alltagswirksamkeit hingegen bezeichnet, wie gut eine Behandlung in der Praxis funktioniert.
- Relative Wirksamkeit: Dies ist das Ausmaß, in dem eine Intervention unter idealen Bedingungen mehr Nutzen als Schaden hat, im Vergleich zu einer oder mehreren alternativen Interventionen.
- Klinische Wirksamkeit: Klinische Wirksamkeit ist ein Maß, das angibt, wie gut eine bestimmte Behandlung in der medizinischen Praxis funktioniert. Diese hängt von der Anwendung der aus der Forschung, der klinischen Erfahrung und Patientenpräferenzen gewonnenen besten Erkenntnisse ab.
- Relative klinische Wirksamkeit: Dies kann als das Ausmaß, in dem eine Intervention in der Erzielung der gewünschten Ergebnisse im Vergleich zu einer oder mehreren Interventionsalternativen mehr Nutzen als Schaden hat, wenn sie unter den üblichen Bedingungen der Gesundheitsversorgung vorgesehen ist, definiert werden.
- Wirtschaftliche Bewertung und Wirtschaftlichkeit: Im Rahmen der Pharmakoökonomie wird die Wirtschaftlichkeit anhand der Ergebnisse verschiedener Eingriffe untersucht, indem ein Einzelergebnis in der Regel in „natürlichen“ Einheiten (z. B. gewonnene Lebensjahre, vermiedene Todesfälle, vermiedene Herzinfarkte oder festgestellte Fälle) gemessen wird.Alternative Eingriffe werden dann anhand der Kosten pro (natürlicher) Einheit verglichen, um das Preis-Leistungsverhältnis zu ermitteln. Hilft Entscheidungsträgern, zu bestimmen, wofür die begrenzten Mittel im Gesundheitswesen eingesetzt werden.Wirtschaftlichkeit ist aber nur eines der Kriterien, die herangezogen werden sollten, um zu entscheiden, ob Eingriffe bereitgestellt werden sollen. Auch andere Aspekte wie Gleichheit, Bedürfnisse, die Auswirkungen auf das Erwerbsleben und Patientenprioritäten sollten im Zuge der wirtschaftlichen Bewertung berücksichtigt werden.
- Auswirkungen auf das Budget: Die Kosten in einem bestimmten Zeitrahmen und im Zusammenhang mit einem bestimmten Gesundheitsbudgets, nicht das Gesamtbudget eines Landes. Dies setzt voraus, dass robuste Daten über Epidemiologie und Behandlungsmuster, sowie Annahmen der Aufnahme und Absetzung aktueller Behandlungen vorliegen.
- Innovative Eigenschaften: Eine Beurteilung, ob die Verwendung des Arzneimittels über den zusätzlichen klinischen Nutzen (wie Komfort für die Patienten beispielsweise durch eine andere Art der Verabreichung, oder andere Merkmale, die die Einhaltung der Therapie verbessern können, mit den daraus resultierenden Verbesserungen der klinischen Ergebnisse und/oder der Qualität des Lebens) hinaus Vorteile hat.
- Verfügbarkeit therapeutischer Alternativen: Eine Beschreibung der sonst noch zur Verfügung stehenden Alternativen, um die Krankheit zu behandeln. Dies kann, muss aber nicht, ein anderes Arzneimittel sein.
- Überlegungen zu Gerechtigkeit: Eine Beurteilung dessen, wie sich die Einführung der neuen Therapie auf Maßnahmen der Angemessenheit innerhalb des Gesundheitssystems auswirken könnte. Zum Beispiel, ob die Therapie für Menschen, die sozial oder wirtschaftlich benachteiligt sind, zu mehr Vorteilen führen würde.
- Auswirkungen auf die Volksgesundheit: Eine Untersuchung der Frage, wie die neue Therapie eine breitere Auswirkung auf die öffentliche Gesundheit haben könnte. So kann beispielsweise eine neue Therapie zur Behandlung von HIV/AIDS die HIV-Übertragungsrate innerhalb einer Gemeinschaft verringern.
Die meisten HTA-Gremien haben für die Unternehmen Leitlinien entwickelt, um diesen Prozess zu vereinheitlichen und angemessene Vergleiche zu erstellen. Diese von Land zu Land unterschiedlichen Richtlinien stehen auf den Websites der meisten HTA-Institutionen zur Verfügung und dienen als Erklärungshilfe, wie Entscheidungen über neue Medikamente gefällt werden.
Dossiers werden von HTA-Institutionen entweder direkt oder mit Hilfe wissenschaftlicher Partner unter die Lupe genommen. Manche HTA-Institutionen führen unabhängige Bewertungen der klinischen und wirtschaftlichen Beweise durch, um Interessenkonflikte zu reduzieren.
HTA: Beurteilung
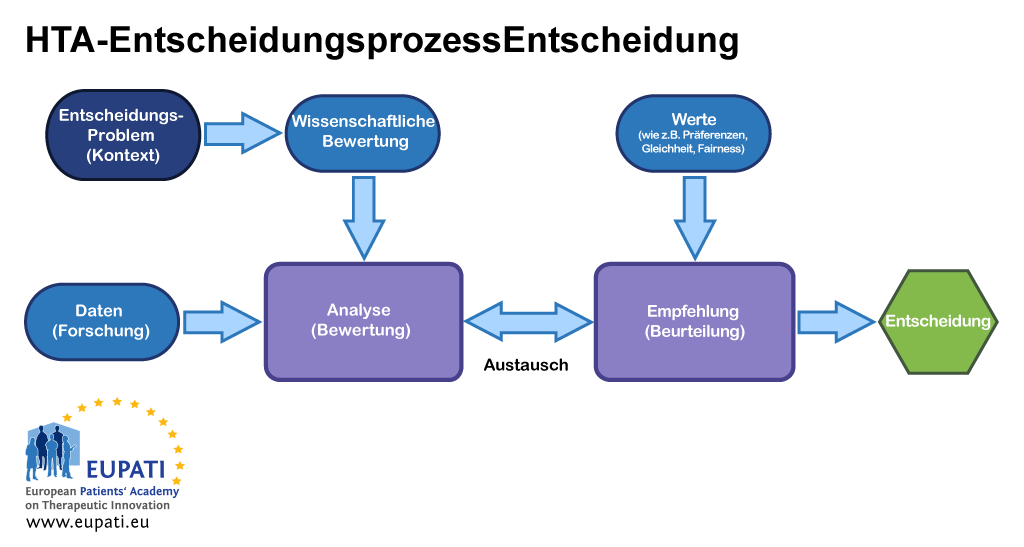
Nachdem die Entscheidung betreffend die Kostenerstattung für eine neue Gesundheitstechnologie umstritten sein kann, besteht der Best-Practice-Ansatz in der Trennung der Beurteilung der Beweise von deren Bewertung, aber auch von der Entscheidungsfindung. Typischerweise werden jene Stellen, die eine Beurteilung durchführen, ihre Empfehlungen auf die Ergebnisse der Beweisbewertung sowie auf zusätzliche Inputs wie etwa die lokale Gesundheitspolitik, Werte und Patientenaussagen stützen.
HTA-Verfahren führen in der Regel zu einer Entscheidung in der Frage, ob die neue Technologie in einem versicherungsbasierten System in die Kostenerstattung aufgenommen (die Liste enthält Arzneimittel mit Erstattung aus der gesetzlichen Krankenversicherung) oder für die Verwendung in einem steuerbasierten staatlichen Gesundheitsdienst empfohlen wird. Dies kann eine Liste oder Empfehlung für die Verwendung des Arzneimittels unter eingeschränkten Bedingungen, zum Beispiel für eine kleinere Patientenpopulation mit schweren Erkrankungen, sein.
- An verschiedenen Stellen im HTA-Entscheidungsprozess sind verschiedene Inputs relevant.
Zu bestimmen, ob eine Intervention die Herzinfarktraten reduzieren, erhebliche Nebenwirkungen oder höhere Kosten verursachen wird, erfordert die Beurteilung der Robustheit der Beweise. Es gibt immer wieder Unsicherheiten in den Beweisen. Natürlich ist es im besten Interesse eines jeden HTA-Gremiums, eine solide wissenschaftliche Beurteilung und konsistente, transparente Ansätze zu verwenden, die zu vertretbaren Entscheidungen führen. Angesichts des multidisziplinären Charakters der HTA, sind die besten Konzepte aus der Epidemiologie, Soziologie, Ökonomie, Ethik, Recht usw. erforderlich, um die verschiedenen Analysen zu unterstützen.
Eine Entscheidung erfordert jedoch auch die Anerkenntnis dessen, was die Gesellschaft und Patienten schätzen. Ist es gut, die Herzinfarktraten zu reduzieren? Zu welchem Preis?
Gute Beurteilungsansätze beziehen mehrere Perspektiven mit ein und können deshalb nicht von einer einzigen Person zufriedenstellend durchgeführt werden. Aus diesem Grund wird ein Ausschuss einberufen, der ein explizites und transparentes Verfahren verwendet, um zu einer Empfehlung zu gelangen. Dieser Prozess wird oft als beratende Beurteilung bezeichnet. Die meisten HTA-Institutionen messen dem Ausmaß (und Stärke der Beweise für) der Erfolge in den patientenrelevanten Gesundheitsergebnissen, die man aus gut konzipierten klinischen Studien mit entsprechenden Vergleichspräparaten kennt, eine größere Bedeutung bei.
Der zweitwichtigste Aspekt sind oft wirtschaftliche Überlegungen. Nahezu alle HTA-Stellen berücksichtigen die finanziellen Auswirkungen (den Gesamtbetrag, den die Nutzung des neuen Arzneimittels im Budget des Gesundheitssystems in einem bestimmten Zeitraum verursacht). Dies sollte ein Netto-Budgetbetrag sein: einer, bei dem die Einsparungen, die an anderer Stelle im Gesundheitssystem als Folge der Vorteile, die mit dem neuen Arzneimittel verbunden auftreten könnten (zum Beispiel weniger Krankenhauseinweisungen wegen schwerer unerwünschter Ereignisse) abgezogen werden. Die Neutralität der Ausschussstruktur muss gewährleistet sein – mit anderen Worten: die Mitglieder des Ausschusses müssen mögliche Interessenkonflikte formell erklären oder ihre Teilnahme ablehnen.
Einige HTA-Institutionen haben einen ethischen Rahmen eingeführt, damit ihre Empfehlungen von einer breiteren Gruppe von Akteuren überprüft werden können. Auf diese Weise können Unternehmen, Ärzte oder Patienten, die zu Unrecht von einer fehlerhaften, voreingenommen oder ungenauen Empfehlung beeinträchtigt werden, eine Berufung einlegen.
Vereinzelt holen HTA-Institutionen die Meinungen der Bürger über die schwierigen Aspekte der Entscheidungsfindung ein, wenn sie über Prioritäten in der Gesundheitsversorgung entscheiden. Zum Beispiel verfügt NICE in Großbritannien über einen Bürgerrat, der mit Hilfe von Bürgerforen soziale Werturteile zur Information des Sachverständigenausschusses von NICE abgibt. Die folgende Liste enthält einige der Fragen, in denen der Bürgerrat beraten hat.
| Jahr | Thema |
|---|---|
| 2002 | Klinischer Bedarf |
| 2003 | Alter und Wirtschaftlichkeit |
| 2004 | Arzneimittel für äußerst seltene Krankheiten und Wirtschaftlichkeit |
| 2005 | Obligatorische Maßnahmen des Gesundheitswesens |
| 2006 | Anwendung der „Rule of Rescue” (Maßnahmen zur Rettung eines akut gefährdeten Patientenlebens) |
| 2007 | Patientensicherheit und Wirtschaftlichkeit |
| 2008 | Die ICER-Schwelle als Ausgangspunkt |
| 2009 | Innovation |
| 2010 | Verbesserung der Gesundheit und finanzielle Anreize |
| 2011 | Diskontierung von Kosten und Nutzen |
| 2012 | Soziale Versorgungswerte |
In einigen Fällen sind die HTA-Ergebnisse mit Preisverhandlungen verknüpft. Preisverhandlungen sind ein Mechanismus für die Regierungen, den Zugang zu neuen Therapien zu ermöglichen (mit anderen Worten, einen zu Weg finden, um nicht „nein ”zu sagen). Andere Variablen umfassen Beschränkungen bezüglich der Empfänger, die die Behandlung unter Erstattungsmechanismen erhalten können.
Jenseits der Empfehlungen
Empfehlungen darüber, ob ein neues Arzneimittel innerhalb eines Gesundheitssystems zur Verfügung gestellt werden soll oder nicht, sind möglicherweise zu starr und bieten aus der Sicht derjenigen, die den Zugang zu neuen Therapien benötigen, keine Flexibilität. Nachdem diese Empfehlungen in der Regel bevölkerungsorientiert sind, lassen sie im Einzelfall keine Ausnahmen zu. Anstelle von Ja/Nein-Empfehlungen werden von der HTA andere, hilfreichere Mechanismen eingesetzt.
- Bedingte Kostenübernahme („CED - Coverage with Evidence Development”): Dies kann verwendet werden, um Zugang zu einem vielversprechenden neuen Arzneimittel, das gegenwärtig über unzureichende Daten zur Unterstützung der klinischen Wirksamkeit oder der Kosteneffizienz verfügt, zu ermöglichen. Unter diesen Umständen kann die HTA die Verwendung des Arzneimittels empfehlen, vorausgesetzt, es liegt eine formale Sammlung von Beweisen vor, um die Unsicherheiten zu beseitigen, während es verwendet wird, beispielsweise in einem Register. Alternativ können von Zulassungsbehörden geforderte klinische Studien am Laufen sein, die zu einem bestimmten Zeitpunkt in der Zukunft zusätzliche Beweise liefern.
- Preisfestsetzung: Der Preis einer Gesundheitstechnologie kann sich direkt auf den Anbieter und den Zugang von Patienten zu dieser Technologie auswirken. In einigen Fällen können Kostenträger mit dem Unternehmen einen Preis auf Basis des wahrgenommenen Wertes der Gesundheitstechnologie verhandeln, vor allem, wenn die Gesundheitstechnologie in einigen, jedoch nicht allen Fällen sinnvoll ist. Dieser Ansatz stellt sicher, dass diese Anbieter und Patienten, die eine bestimmte Technologie benötigen, auch Zugriff darauf haben. HTA-Gremien können, müssen aber nicht, in dieses Verfahren einbezogen werden. Jedoch bringt die wertorientierte Preisbildung auch Herausforderungen mit sich, da es schwierig ist, sicherzustellen, dass alle Aspekte des Nutzens einer Gesundheitstechnologie angemessen berücksichtigt werden. Zum Beispiel offenbaren die Ergebnisse kurzfristiger klinischer Studien nicht die Eigenschaften des Produktes, die für die Patienten wertvoll sind, wie etwa Komfort der Dosierungspläne oder weniger invasive Methoden der Verabreichung.
- Entscheidungshilfen und klinische Leitlinien: Die HTA kann darauf hinweisen, dass das Arzneimittel den größten Nutzen hat, wenn es in einer bestimmten Patientengruppe oder in einer bestimmten Reihenfolge nach anderen Behandlungsmöglichkeiten eingesetzt wird. Im Sinne der Nutzenoptimierung kann der Kostenträger beschließen, die Kosten für das Arzneimittel in Verbindung mit spezifischen klinischen Leitlinien (für verordnende Ärzte) oder spezifischen Entscheidungshilfen (für Patienten und Ärzte) zu erstatten. Entscheidungshilfen sind Werkzeuge für Patienten und Ärzte, um Beweise zu verwenden, um eine fundierte individuelle Entscheidung zu treffen. Sie helfen Patienten, zwischen zwei Behandlungen, die verschiedene Risiken und Vorteile haben, zu wählen. Sie ermöglichen den Patienten, besser informierte Diskussion mit ihrem Arzt über das, was sie am meisten schätzen, zu führen und zu bestimmen, welche die beste Option für sie ist.1
- Festlegung von Prioritäten und Budgets im Gesundheitssystem: Es wurden Methoden entwickelt, um die HTA-Informationen zu verwenden, um festzustellen, welche Dienste bezahlt werden sollten (z.B. um festzustellen, welche Dienste in die allgemeine Krankenversicherung aufgenommen werden sollten). Das heißt: die optimale Mischung zu finden, die Mehrwert bietet und auch für den Kostenträger erschwinglich ist.2
HTA-Netzwerke
Viele HTA-Organisationen in Europa sind auch durch das im Jahr 2004 gegründeten European Union Network of HTA organisations (EUnetHTA) miteinander verbunden. EUnetHTA arbeitet eng mit der EU-Kommission, der Europäischen Arzneimittel-Agentur (EMA) und Interessenverbänden, die die Interessen von Patienten/Verbrauchern vertreten, der Industrie, Kostenträgern (GKV) und Gesundheitsdienstleistern zusammen. EUnetHTA arbeitet an der Entwicklung von Methoden, Standards und Verfahren des Netzwerks für HTA in Europa (HTA-Netzwerk).
Das HTA-Netzwerk fördert gute HTA-Praktiken und Methoden als Antwort auf die hohe Vielfalt der europäischen HTA-Methoden, Praktiken und Ergebnisse sowie das hohe Ausmaß an Doppelarbeit. Ein weiteres Ziel ist die effiziente Nutzung von HTA-Ressourcen in Europa. Zu den Hauptaktivitäten, die EUnetHTA für das HTA-Netzwerk übernimmt, gehört die Entwicklung von HTA-Methodik-Richtlinien und die Erprobung gemeinsamer Bewertungen der relativen Wirksamkeit. Diese Maßnahmen werden dazu beitragen, die Arbeitslast auf nationaler Ebene zu reduzieren und machen es HTA-Institutionen auf der Ebene der Mitgliedstaaten einfacher, die zusätzlichen Analysen durchzuführen und Entscheidungen zu treffen, die für ihr Gesundheitssystem spezifisch sind.
Weitergehende Informationen
- Health Technology Assessment Network. Stand: 6. Januar 2016, von https://ec.europa.eu/health/technology_assessment/policy/network
- EUnetHTA: http://www.eunethta.eu/ (Stand: 6 Januar, 2016)
- Möglichkeiten für Patienten, sich an der EUnetHTA zu beteiligen: http://www.eunethta.eu/ (Stand: 6 Januar, 2016).
- Sorenson, C., Drummond, M., and Panos, K. (2008). Ensuring value for money in health care: The role of health technology assessment in the European Union. Copenhagen: World Health Organization. Stand: 6. Januar, 2016, von http://www.euro.who.int/__data/assets/pdf_file/0011/98291/E91271.pdf
- Velasco Garrido, M., Kristensen, F.B., Nielsen, C.P, and Busse, R. (2008). Health technology assessment and health policy-making in Europe: Current status, challenges and potential. Copenhagen: World Health Organization. Stand: 6. Januar, 2016, von http://www.euro.who.int/__data/assets/pdf_file/0003/90426/E91922.pdf
- Kleinjen, S., George, E., Goulden, S., et al. (2012). ‘Relative effectiveness assessment of pharmaceuticals: similarities and differences in 29 jurisdictions’. Value Health, (15), 954-960. Stand: 6 Januar, 2016, von http://www.valueinhealthjournal.com/article/S1098-3015(12)01609-9/pdf
- Rawlins, M. (2014). ‘Evidence, values, and decision-making.’ International Journal of Technology Assessment in Health Care, (30), 233-238.
Quellenangaben
- Ottawa Hospital Research Institute (2014). Patient Decision Aids: Implementation Toolkit. Retrieved 6 January, 2016, from http://decisionaid.ohri.ca/implement.html
- Bandolier (2007). Programme budgeting and marginal analysis. Retrieved 6 January, 2016, from http://www.bandolier.org.uk/booth/glossary/PBMA.html
A2-6.05-v1.1