Grundlagen der frühen klinischen Entwicklung
[glossary_exclude]Was ist frühe klinische Entwicklung?[/glossary_exclude]
Frühe klinische Entwicklung bezieht sich im Allgemeinen auf die ersten, mit einem Arzneimittel am Menschen durchgeführten Studien – auch bekannt als Phase-I und Phase-II-Studien.
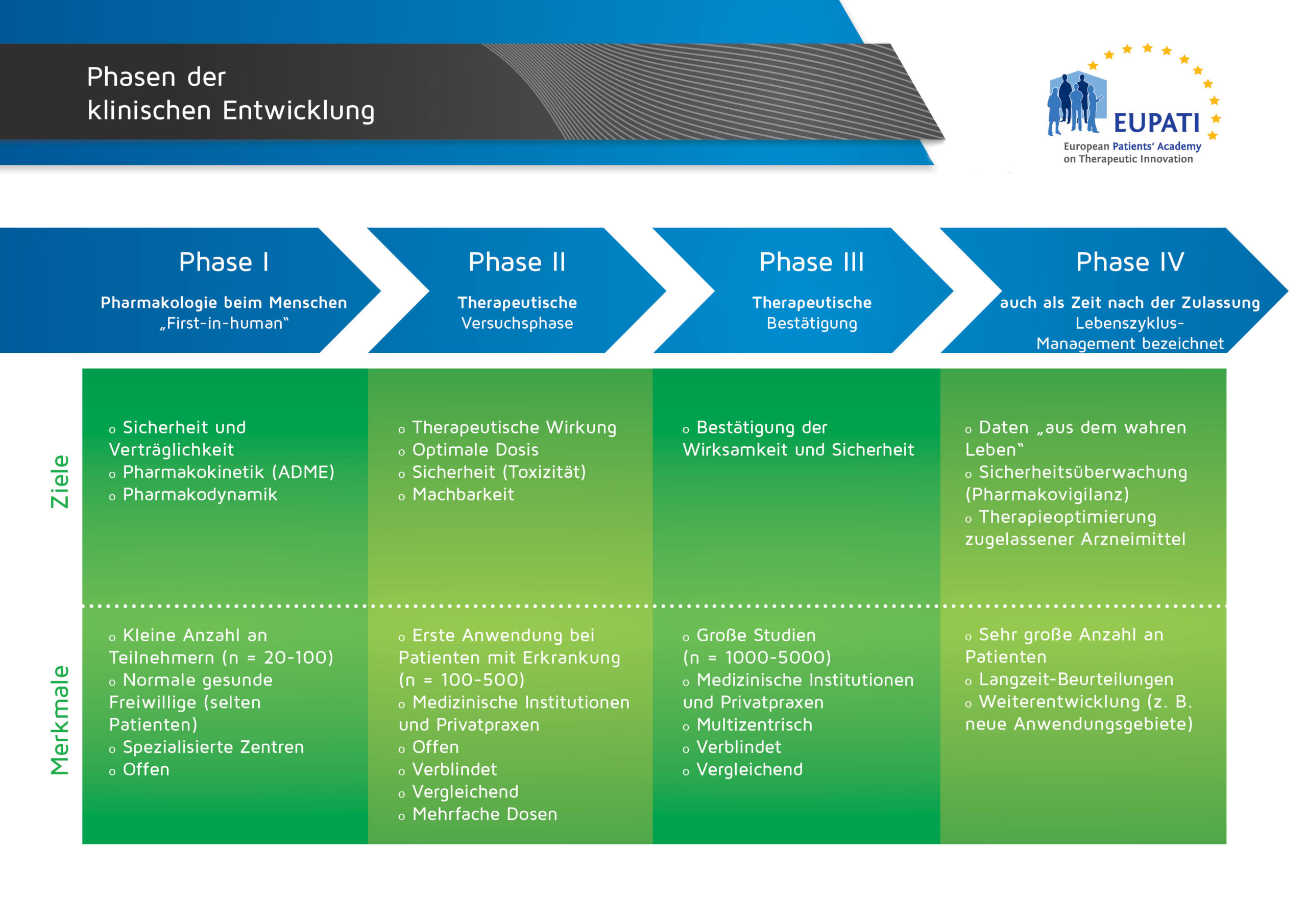
Die Phasen der klinischen Entwicklung sind in der Regel als aufeinanderfolgende Phasen dargestellt, wie die folgende Abbildung zeigt:
- Die vier Phasen der klinischen Entwicklung unterscheiden sich in Bezug auf ihre Ziele und Merkmale.
Die Logik hinter der Darstellung der Arzneimittelentwicklung in aufeinanderfolgenden Phasen beruht auf dem Konzept, wonach die Ergebnisse früherer Studien die Pläne für spätere Studien beeinflussen sollen: die resultierenden Daten veranlassen häufig Änderungen der Entwicklungsstrategien.
Allerdings werden Studien auch in Phasen eingeteilt – nicht nur nach ihrer Durchführung, sondern auch entsprechend ihren Zielen. In einigen Fällen können Studien mehrere Phasen mit unterschiedlichen grundlegenden Zielen verbinden.
Mit anderen Worten: entsprechend dem Fortgang der Entwicklung eines Arzneimittels können neue Daten auf die Notwendigkeit für zusätzliche Studien, die typischerweise Teil einer früheren Phase sind, hindeuten. Beispielsweise werden Pharmakologiestudien beim Menschen zwar typischerweise während der Phase I durchgeführt, werden viele dieser Studien dennoch auch in allen späteren Phasen durchgeführt (siehe Abbildung unten).
[glossary_exclude]Was sind die Zielsetzungen der frühen klinischen Entwicklung?[/glossary_exclude]
Im Mittelpunkt der Studien in der frühen klinischen Entwicklung stehen Sicherheit und Verträglichkeit des neuen Arzneimittels. In diesen Studien soll auch gezeigt werden, dass das Arzneimittel die beabsichtigte Wirkung haben kann.
Folgende Schlüsselfragen müssen während der frühen klinischen Entwicklung beantwortet werden:
-
Phase I
- Ist das Arzneimittel sicher beim Menschen? Auf welchen Stufen? (Toleranz)
- Was macht der Körper mit dem Arzneimittel? (Pharmakokinetik [PK])
- Was macht das Arzneimittel mit dem Körper? (Pharmakodynamik [PD])
- Welche Wechselwirkungen gibt es? (Wirkstoff-Wirkstoff-Wechselwirkungen, Wechselwirkungen mit Lebensmitteln, usw.)
- Ist das Arzneimittel aktiv?
-
Phase II
- Ist das Arzneimittel sicher bei Patienten? (Sicherheit)
- Was macht das Arzneimittel mit dem Körper? (Pharmakodynamik [PD])
- Scheint das Arzneimittel bei Patienten zu wirken? Bei welchen Dosen? (Wirkung)
- Wie sollten konfirmatorische Prüfungen gestaltet werden? (Endpunkte, Zielpopulation, andere Arzneimittel, die eingenommen werden [begleitend], usw.)
[glossary_exclude]Was sind die Voraussetzungen für die frühe klinische Entwicklung?[/glossary_exclude]
Bevor die frühe klinische Entwicklung eines Arzneimittels beginnen kann, muss es genügend Daten aus nicht-klinischen Studien geben, die die Arzneimittelsicherheit für die Verabreichung an Menschen unterstützen. Dann muss ein klinischer Entwicklungsplan zusammengestellt werden, in dem
- die Zielsetzungen des klinischen Programmes etabliert werden.
- die Anforderungen, die erfüllt sein müssen, damit ein Machbarkeitsnachweis als positiv gilt, festgelegt werden.
- Design und Durchführung der klinischen Studien der Phasen I und II beschrieben werden.
[glossary_exclude]Wie werden Entscheidungen während der frühen klinischen Entwicklung getroffen?[/glossary_exclude]
Entwicklungsentscheidungen sind datengetrieben. Die Ergebnisse von Studien werden sorgfältig geprüft, bevor die Entwicklung fortgesetzt wird. Der Machbarkeitsnachweis muss erreicht und ein Dosierungsschema gewählt werden, bevor die weitere Entwicklung fortgesetzt werden kann. Wenn die frühe klinische Entwicklung eines Arzneimittels positive Ergebnisse liefert, können weitere Tests des Arzneimittels erfolgen. Unklare Ergebnisse in der frühen klinischen Entwicklung erfordern weitere Prüfungen und eine Bewertung, bevor Entscheidungen getroffen werden können. Liefert die frühe klinische Entwicklung eines Arzneimittels negative Ergebnisse – zum Beispiel, wenn das Konzept nicht hinreichend belegt ist oder unzumutbare Sicherheitsprobleme entstehen – wird die Entwicklung des Arzneimittels eingestellt. Dies ist der Punkt, an dem die Entwicklung einer großen Anzahl potenzieller Arzneimittel abgesetzt werden muss.
A2-5.03.1-V1.1