Geneesmiddel voor pediatrisch gebruik: pediatrisch onderzoeksplan
Inleiding
Voor de normale ontwikkeling van een geneesmiddel moeten diverse onderzoeken worden uitgevoerd om de kwaliteit, veiligheid en werkzaamheid van het middel te garanderen. Deze onderzoeken vereisen op hun beurt zorgvuldige planningsprocedures om er zeker van te zijn dat ze ethisch en wetenschappelijk deugdelijk zijn. Tijdens het ontwikkelingsproces wordt er een pediatrisch onderzoeksplan geschreven om te zorgen dat de noodzakelijke gegevens over het gebruik van het geneesmiddel bij kinderen worden verkregen zodra dit veilig is.
Pediatrisch onderzoeksplan (PIP)
Het doel van een PIP is de goedkeuring van een geneesmiddel bij kinderen te ondersteunen. Zodra over het PIP overeenstemming is bereikt, wordt het door een wijzigingsprocedure up-to-date gehouden.
Een PIP omvat het volgende:
- De behoeften van kinderen van alle leeftijdsgroepen, vanaf geboorte tot de adolescentie, en de timing van onderzoeken bij kinderen versus die bij volwassenen De gehele pediatrische leeftijdsgroep tenzij afwijking hiervan verantwoord is
- Een overzicht van de ziekte, de diagnose en de behandeling ervan (een PIP moet eventuele verschillen tussen kinderen en volwassenen uitlichten)
- Een overzicht van de gegevens die voor het geneesmiddel beschikbaar zijn, zoals:
- Chemische informatie over de huidige formulering
- Niet-klinische en klinische onderzoeksgegevens
- Voorgestelde strategie waaronder enkele of alle van de volgende:
- Een beschrijving van eventuele aanvullende niet-klinische onderzoeken
- Plannen voor een pediatrische formulering (indien vereist), met onder meer maatregelen om de formulering van het geneesmiddel aan te passen zodat het gebruik ervan aanvaardbaarder wordt voor kinderen, zoals het gebruik van een vloeibare formulering in plaats van grote tabletten.
- Een beschrijving van geplande klinische onderzoeken of modellering/simulatie (met computers om te voorspellen hoe het geneesmiddel bij kinderen kan werken) zoals:
- bijzonderheden van de timing van de onderzoeken bij kinderen in vergelijking met het ontwikkelingsplan voor volwassenen.
- Als de onderzoeken bij kinderen niet parallel worden uitgevoerd, kan om uitstel worden gevraagd voor de afronding van het PIP.
Het PIP wordt door de aanvrager ingediend bij het ‘Paediatric Committee’ (PDCO). Wettelijk is het verplicht dat een PIP ‘niet later wordt ingediend dan de afronding van farmacokinetische onderzoeken bij volwassenen’. Doorgaans wordt het PIP ingediend zodra er klinische ervaring bij volwassenen is opgedaan. Als een PIP wordt afgerond en pediatrische gegevens in de productinformatie voor de EU worden opgenomen, wordt als beloning het ‘Supplementary Protection Certificate’ (SPC) met zes maanden verlengd.
Het ‘Paediatric Committee’ (PDCO) van het EMA
Het ‘Paediatric Committee’ (PDCO) beoordeelt de inhoud van een PIP, eventuele verzoeken om vrijstelling en uitstel, en verstrekt een analyse en een kritische beoordeling door deskundigen om een ‘advies’ aan te nemen om te bepalen of het PIP wel of niet aanvaardbaar is. In het PDCO zijn patiëntvertegenwoordigers opgenomen.
Op verzoek beoordeelt het comité gegevens die zijn verkregen nadat overeenstemming is bereikt over een PIP. Ze houden ook het volgende bij:
- Een lijst met geneesmiddelklassen of producten voor vrijstelling
- Een bijgewerkt overzicht van vastgestelde pediatrische behoeften aan de hand van verzamelde gegevens.
Ze gebruiken deze informatie voor advies aan Europese pediatrische onderzoeksnetwerken over ziekten die moeten worden onderzocht en waarvoor pediatrische formuleringen van bestaande geneesmiddelen nodig zijn.
De EU-wetgeving wordt continu beoordeeld en herzien, wat de gelegenheid biedt het proces te optimaliseren om geneesmiddelen beschikbaar te maken voor patiënten. Er wordt om input gevraagd van alle belanghebbenden, zoals artsen, zorgprofessionals, farmaceutische bedrijven, patiënten en patiëntenorganisaties.
Overzicht van de PIP-procedure
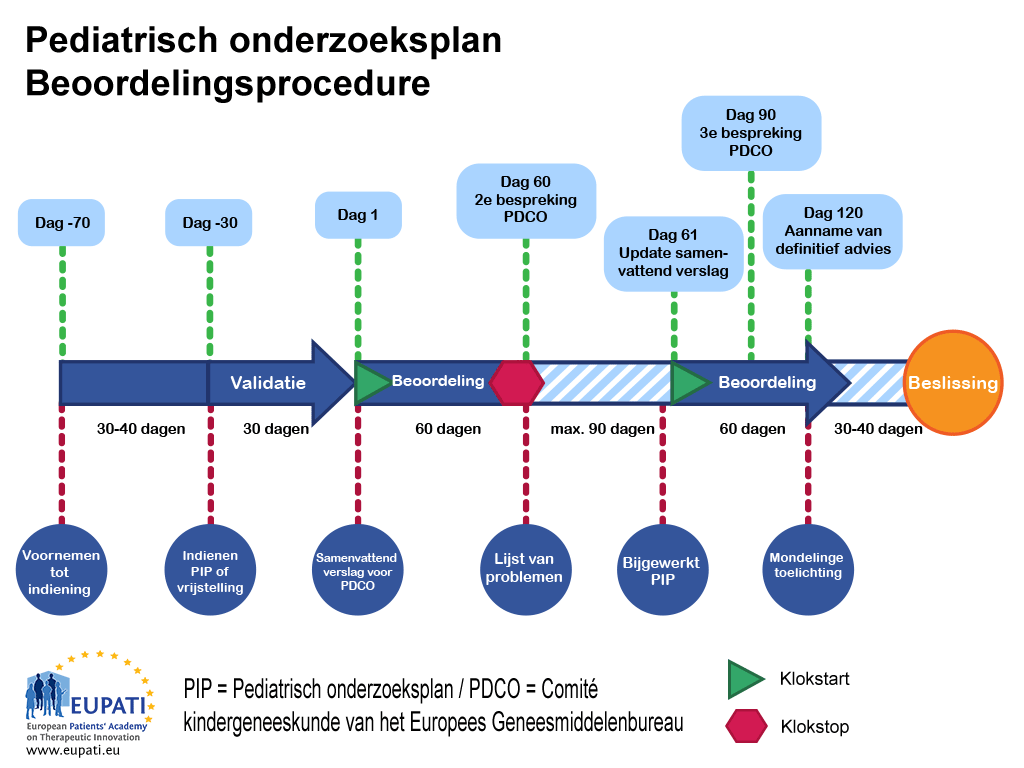
- Een pediatrisch onderzoeksplan wordt beoordeeld door het ‘Paediatric Committee’ (comité kindergeneeskunde) van het Europees Geneesmiddelenbureau (EMA) volgens een vastgestelde procedure met gedefinieerde tijdslijnen.
De PIP-procedure neemt 9 tot 10 maanden in beslag van indiening tot besluit. Zodra de aanvrager een beoordelingsaanvraag indient, wijst de PDCO een ‘rapporteur’ aan om de beoordeling te leiden en een ‘peer reviewer’ om vanuit het comité zelf de kwaliteit van de beoordeling te controleren. De rapporteur en ‘peer reviewer’ controleren de initiële PIP en presenteren hun bevindingen aan het PDCO.
Het beoordelingsproces is een procedure van 120 dagen; op dag 60 is er echter een pauze (‘clock stop’) waardoor het PDCO vragen aan de aanvrager kan stellen. Deze ‘clock stops’ gelden doorgaans voor maximaal drie maanden, hoewel de duur per geval met het PDCO wordt overeengekomen.
Zodra de antwoorden van de aanvrager zijn ingediend, start de klok weer op dag 61 en loopt de procedure zonder onderbreking door tot deze eindigt op dag 120. Dit houdt in dat eventuele nog openstaande vragen tijdens de procedure moeten worden behandeld. Als er na de derde discussie met het PDCO nog steeds vragen onbeantwoord zijn, kan het PDCO of de aanvrager verzoeken om een mondelinge toelichting. Dit stelt de aanvrager in staat direct met het gehele comité te spreken.
PIP-vrijstellingen
Een vrijstelling die de sponsor ontheft van indiening van een PIP, kan worden verleend wanneer:
- het geneesmiddel waarschijnlijk bij kinderen niet werkt of onveilig is;
- de ziekte of aandoening alleen bij volwassenen voorkomt of
- er geen ‘aanzienlijk therapeutisch voordeel’ is waargenomen, of wanneer het aannemelijk is gemaakt dat er problemen bestaan inzake de haalbaarheid, wat betekent dat er geen aanzienlijk therapeutisch voordeel kan worden aangetoond.
Er zijn drie typen vrijstelling:
- Klassevrijstelling – volgens een door het PDCO gepubliceerde lijst aandoeningen die alleen bij volwassenen voorkomen. Het PDCO overweegt momenteel om alle klassevrijstellingen (voornamelijk gerelateerd aan kanker) te verwijderen.
- Volledige vrijstelling – voor alle pediatrische subgroep(en) en indicatie(s)
- Gedeeltelijke vrijstelling – voor een of meer pediatrische subgroep(en) en indicatie(s)
Een vrijstelling kan worden beoordeeld en gewijzigd. Als een vrijstelling wordt herroepen, vervalt de eis om gegevens in te dienen volgens een overeengekomen PIP gedurende 36 maanden.
Overige informatiebronnen
- Raadpleeg voor meer informatie over de rollen van het PDCO: European Medicines Agency (2010). Roles and responsibilities of members and alternates, rapporteur and peer reviewers, experts and observers of the Paediatric Committee (PDCO). Geraadpleegd op 25 augustus 2015 op http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004754.pdf
- Raadpleeg voor meer informatie over het PDCO: European Medicines Agency (2015). PDCO: Overview. Geraadpleegd op 25 augustus 2015 op http://www.ema.europa.eu/ema/index.jsp?curl=pages/about_us/general/general_content_000124.jsp&mid=WC0b01ac0580028e9e
- Voor veelgestelde vragen over de PIP-procedure, kijk naar: European Medicines Agency (2014). Questions and answers on the procedure of PIP compliance verification at EMA, and on paediatric rewards. Geraadpleegd op 25 augustus 2015 op http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/09/WC500003916.pdf
A2-1.18.4-v1.1