Evidensbaseret medicin
Introduktion
Lisa har svære smerter efter en operation. Lægen skal vælge mellem at give tabletter, hvilket er i overensstemmelse med ekstern klinisk evidens, eller injektion, hvilket er i overensstemmelse med lægens personlige kliniske erfaring og patientens præferencer. Lægen ved, at morfintabletter ville være det bedste valg i henhold til ekstern klinisk evidens. En almindelig bivirkning ved den anæstesi, som Lisa får under en operation, er dog opkastning. Det betyder, at hvis Lisa får en tablet og begynder at kaste op, vil tabletten komme op igen, og så opnår hun ingen smertestillende virkning. Lægen og Lisa ved af erfaring, at Lisa sandsynligvis vil begynde at kaste op, inden for 30 minutter efter at anæstesien er ophørt. Derfor beslutter lægen at give Lisa en injektion, der indeholder morfin, i stedet for.
I eksemplet beslutter lægen ud fra sin personlige kliniske erfaring og patientens præferencer at bruge en morfininjektion i stedet for morfintabletter, som har den bedste eksterne kliniske evidens. Lægen bruger samme aktive stof (dvs. morfin), som foreslås i den eksterne kliniske evidens, men vælger at bruge en anden formulering (nemlig injektion i stedet for tablet).
Dette er et eksempel på, hvordan en læge når frem til en specifik, evidensbaseret behandlingsbeslutning efter drøftelser med patienten.
Hvad er evidensbaseret medicin?
Evidensbaseret medicin (EBM) er processen med en systematisk gennemgang, bedømmelse og anvendelse af kliniske forskningsresultater for at bidrage til opnåelsen af den bedst mulige kliniske pleje til patienterne. Patienternes viden om evidensbaseret medicin er vigtig, da det giver dem mulighed for at træffe mere informerede beslutninger om sygdomshåndtering og -behandling. Det giver også patienterne en mere nøjagtig idé om risikoen, fremmer korrekt brug af elektive procedurer og støtter evidensbaseret beslutningstagning hos læger og patienter.
Evidensbaseret medicin er en kombination af principper og metoder. Når de bliver anvendt, sikrer de, at medicinske beslutninger, retningslinjer og politikker er baseret på den nuværende bedste evidens med hensyn til effekten af forskellige former for behandling og sundhedspleje generelt. Hvad lægemidler angår, tager den i høj grad udgangspunkt i oplysningerne fra vurderingen af fordele og risici (virkning og sikkerhed).
Begrebet evidensbaseret medicin opstod i 1950’erne. Inden da var medicinske beslutninger hovedsagelig baseret på medicinsk uddannelse, klinisk erfaring og læsning af medicinske tidsskrifter. Undersøgelser viste dog, at beslutningerne om medicinsk behandling var meget forskellige fra den ene sundhedsfaglige person til den anden. Grunden var lagt til at indføre systematiske metoder til at indsamle, evaluere og organisere forskningsdata – hvilket førte til evidensbaseret medicin. Siden sin indførelse er evidensbaseret medicin blevet anerkendt af læger, medicinalvirksomheder, lægemiddelmyndigheder og den almindelige offentlighed.
Beslutningstagerne skal bruge den viden, de har fra deres egen kliniske erfaring, sammen med den bedste evidens fra kontrollerede undersøgelser og forskning. Det er vigtigt at kombinere klinisk erfaring og kontrollerede undersøgelser i beslutningstagningsprocessen. Uden klinisk erfaring kan risikoen i forbindelse med en given behandling ende med at forårsage uønskede virkninger.
5-trinsmodellen for evidensbaseret medicin
En tilgang til evidensbaseret medicin bygger på en 5-trinsmodel:
- Definition af et klinisk relevant spørgsmål (lægen søger efter information for at stille den korrekte diagnose)
- Søgning efter den bedste evidens (lægen søger efter evidens for at underbygge resultaterne fra trin 1)
- Vurdering af evidensens kvalitet (lægen sikrer, at kvaliteten og pålideligheden er høj)
- Handling ud fra evidensen for at træffe en klinisk beslutning (patienten og lægen træffer i fællesskab en informeret behandlingsbeslutning ud fra trin 1-3)
- Evaluering af processen (lægen og patienten vurderer, om det tilsigtede resultat er opnået og justerer om nødvendigt behandlingsbeslutningerne i overensstemmelse hermed)
Hvad angår det eksempel, der blev nævnt i starten, er lægens valg i overensstemmelse med principperne for evidensbaseret medicin og med patientens feedback. Lægens beslutning er et udtryk for en samvittighedsfuld, klar og velovervejet brug af den bedste evidens på det aktuelle tidspunkt, herunder patientens erfaring, når det besluttes, hvordan en given patient får den bedst mulige medicinske behandling.
Patienternes inddragelse i beslutningstagningsprocesserne spiller en vigtig rolle, når det gælder om at fastlægge nye retningslinjer for behandlingsprincipperne. Dette omfatter at læse, forstå og handle ud fra sundhedsinformation, at samarbejde med klinikerne om at vurdere og vælge de rette behandlingsmuligheder og at give feedback om resultaterne. Patienterne kan spille en aktiv rolle på alle evidensniveauer.
Vurdering af evidens i evidensbaseret medicin
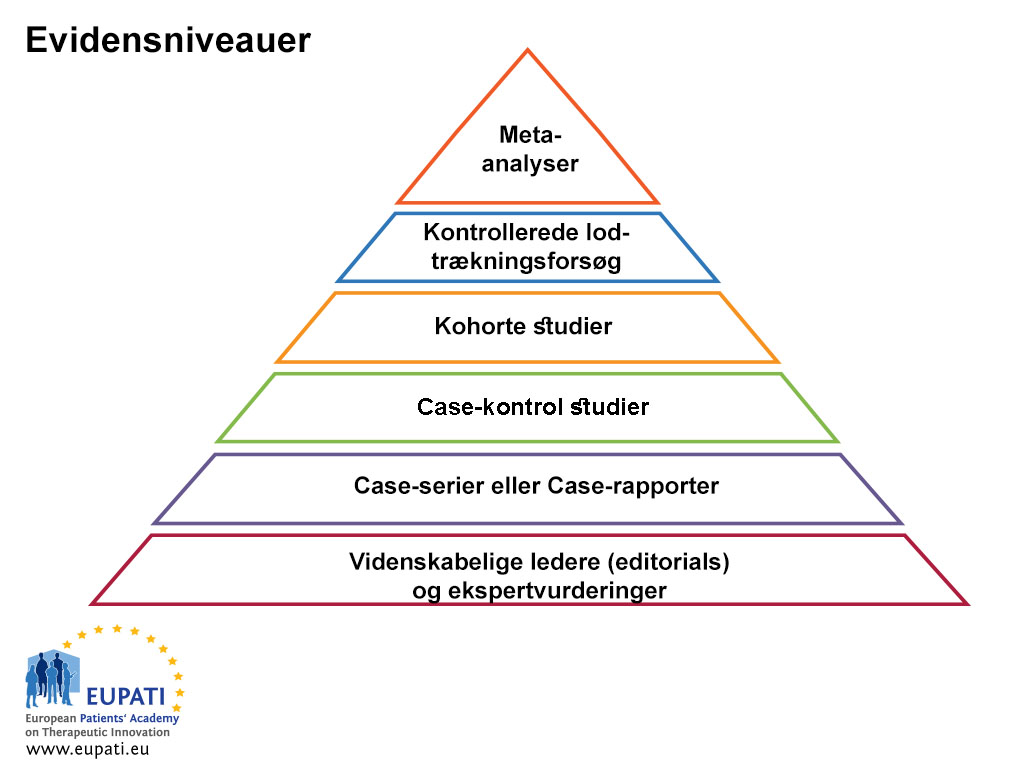
For at vurdere evidensens kvalitet rangordnes den indsamlede information efter de forskellige evidensniveauer. Pyramiden i figuren nedenfor viser de forskellige evidensniveauer og deres indbyrdes rangorden.
- Evidensniveauer er nyttige når man skal vurdere kvaliteten af evidens.
Redaktions- og ekspertudtalelser
Her er der tale om evidens baseret på udtalelserne fra et ekspertpanel med det formål at præge almen medicinsk praksis.
Case-serier og case-rapporter
Case-serier er deskriptive undersøgelser, som følger en lille gruppe mennesker. De er tilføjelser eller supplementer til case-rapporter. En case-rapport er en detaljeret rapport over en enkelt patients symptomer, tegn, diagnose, behandling og opfølgning.
Case-kontrolundersøgelse
En case-kontrolundersøgelse er en retrospektiv observationsundersøgelse (undersøgelse af historiske data), som sammenligner patienter, der har en sygdom, med patienter, der ikke har den pågældende sygdom. Udfald såsom lungekræft undersøges almindeligvis ved hjælp af case-kontrolundersøgelser. En gruppe rygere (den eksponerede gruppe) og en gruppe ikke-rygere (den ikke-eksponerede gruppe) rekrutteres og følges over tid. Herefter dokumenteres forskellene i forekomsten af lungekræft hos de to grupper, idet man isolerer den variabel, der vurderes (den "uafhængige variabel" – i dette tilfælde rygning) som årsagen til den "afhængige variabel" (i dette tilfælde lungekræft).
I dette eksempel ville en statistisk signifikant stigning i forekomsten af lungekræft hos rygergruppen sammenlignet med ikke-rygergruppen blive betragtet som evidens for antagelsen af en årsagssammenhæng mellem rygning og lungekræft.
Kohorteundersøgelse
Den moderne definition af en "kohorte" i kliniske undersøgelser er en gruppe personer med bestemte karakteristika, som følges for at fastlægge nogle helbredsrelaterede resultater.
Framingham Heart Study er et eksempel på brugen af en kohorteundersøgelse for at få svar på et epidemiologisk spørgsmål. Framingham-undersøgelsen begyndte i 1948 og er endnu ikke afsluttet. Formålet er at undersøge indvirkningen af flere faktorer på forekomsten af hjertesygdomme. Det spørgsmål, som man ønsker at besvare med undersøgelsen, er følgende: Har faktorer som forhøjet blodtryk, rygning, overvægt, diabetes, motion osv. en forbindelse til udviklingen af hjertesygdom? For at undersøge hver eksponering (f.eks. rygning) rekrutterer investigatorerne en kohorte af rygere (den eksponerede gruppe) og en kohorte af ikke-rygere (den ikke-eksponerede gruppe). Kohorterne bliver så fulgt i et bestemt stykke tid. Efter dette tidsrum bliver forskellene i kohorternes forekomst af hjertesygdom dokumenteret. Kohorterne sammenlignes med hensyn til mange andre variabler såsom:
- Økonomisk status (f.eks. uddannelse, indkomst og beskæftigelse)
- Helbredsstatus (f.eks. tilstedeværelsen af andre sygdomme)
Det betyder, at den variabel, der vurderes, den "uafhængige variabel" (i dette tilfælde rygning), kan isoleres som årsagen til den "afhængige variabel" (i dette tilfælde hjertesygdom).
I dette eksempel er en statistisk signifikant stigning i forekomsten af hjertesygdom hos rygergruppen sammenlignet med ikke-rygergruppen evidens for antagelsen af en årsagssammenhæng mellem rygning og udviklingen af hjertesygdom. Resultaterne af Framingham Heart Study har i årenes løb skabt afgørende evidens for, at hjerte-kar-sygdomme i høj grad skyldes målbare risikofaktorer, som det er muligt at ændre, og at man kan få kontrol over sin hjertesundhed ved at: kigge nøje på sin kost og livsstil og ændre sit indtag af mættet fedt, kolesterol og rygevaner, tabe sig eller være fysisk aktiv og regulere stressniveauet og blodtrykket. Det er hovedsagelig på grund af Framingham Heart Study, at vi har opnået en god forståelse for sammenhængen mellem visse risikofaktorer og hjertesygdom.
Et andet eksempel på en kohorteundersøgelse, der har kørt i mange år, er NCDS-undersøgelsen (National Child Development Study), som er den mest omfattende af de britiske fødselskohorteundersøgelser. Den største undersøgelse i kvinder er Nurses Health Study. Denne undersøgelse begyndte i 1976 og følger over 120.000 personer. Data fra denne undersøgelse er blevet analyseret for mange forskellige forhold og udfald.
Randomiseret klinisk forsøg
I et randomiseret klinisk forsøg bruges randomisering, når deltagerne skal fordeles på forskellige arme i undersøgelsen. Det betyder, at behandlingsgrupperne vælges tilfældigt ved hjælp af et formelt system, og at alle deltagere har samme sandsynlighed for at blive valgt til hver arm.
Metaanalyse
En metaanalyse er en systematisk, statistikbaseret gennemgang af data, der sammenligner og kombinerer resultaterne af forskellige, men relaterede undersøgelser, med sigte på at identificere mønstre, uoverensstemmelser og andre sammenhænge på tværs af flere undersøgelser. En metaanalyse kan støtte en stærkere konklusion end nogen individuel undersøgelse, men den kan være fejlbehæftet på grund af publikationsbias.
Resultatforskning
Resultatforskning er et bredt paraplybegreb uden en konsekvent definition. Kort fortalt undersøger man med resultatforskning slutresultaterne af medicinsk behandling – dvs. effekten af sundhedsplejeprocessen på patienters sundhed og velbefindende. Forskning i kliniske resultater tager med andre ord sigte på at overvåge, forstå og forbedre den indvirkning, som medicinsk behandling har på en specifik patient eller population. Den beskriver ofte forskning, der drejer sig om effektiviteten af folkesundhedsinterventioner og sundhedstjenester, dvs. resultaterne af disse tjenester.
Det er ofte den berørte person, der er i fokus – eller med andre ord de kliniske endepunkter (overordnede resultater), der er mest relevante for patienten eller populationen. Sådanne endepunkter kunne være livskvalitet eller smerteniveau. Resultatforskning kan dog også fokusere på sundhedssystemernes effektivitet med målinger såsom omkostningseffektivitet, helbredsstatus og sygdomsbyrde (den indvirkning, som sundhedsproblemet har).
Forskellen mellem EBM og resultatforskning er, hvad der er i fokus: Mens EBM hovedsagelig har fokus på at give den bedste pleje til patienten i overensstemmelse med klinisk evidens og erfaring, har resultatforskning hovedsagelig fokus på de fastlagte endepunkter. I klinisk resultatforskning er disse endepunkter som regel klinisk relevante endepunkter.
| Type endepunkt | Eksempel |
|---|---|
| Fysiologisk måling (biomarkør) | Blodtryk |
| Klinisk | Blodtryk |
| Symptomer | Hoste |
| Funktionelle og pleje | Måling af funktion, f.eks. evnen til at udføre almindelige hverdagsopgaver, og vurderinger af livskvalitet |
I resultatforskning er de relevante endepunkter ofte symptomer eller funktionelle målinger og målinger af pleje – ting, der anses for vigtige af den patient, der modtager behandlingen. F.eks. kan en patient, der har en infektion og derfor får penicillin, være mere interesseret i at få feberen til at forsvinde og få det bedre, end de er interesserede i penicillinens effekt på det reelle infektionsniveau. I dette tilfælde betragtes deres symptomer, og hvordan de har det, som en direkte vurdering af deres helbredsstatus – det er med andre ord de endepunkter, som resultatforskning ville fokusere på. Det er også sandsynligt, at patienterne er interesserede i de potentielle bivirkninger ved penicillinen og i behandlingens omkostninger. Når det gælder andre sygdomme, såsom kræft, er et vigtigt klinisk resultat, der er relevant for patienten, risikoen for at dø.
Hvis undersøgelsen varer i længere tid, kan resultatforskningen omfatte brugen af "surrogat-endepunkter". Et surrogat-endepunkt er, når en biomarkør anvendes til at måle et resultat – det fungerer som en erstatning for et endepunkt for klinisk virkning. Som eksempel kan nævnes en klinisk undersøgelse, hvor penicillinbehandlingens effekt måles ud fra et fald i mængden af et specifikt protein (kaldet "C-reaktivt protein"), der altid er til stede i blodet. Hos en rask person er mængden af dette protein i blodet meget lille, men det stiger dramatisk ved en akut infektion. At måle niveauet af C-reaktivt protein er således en indirekte måde at måle infektionen i kroppen på – i dette tilfælde fungerer proteinet som en "biomarkør" for infektion. En biomarkør er en målbar indikator for en sygdomstilstand. Den hænger således sammen med risikoen for eller udviklingen af en sygdom, eller hvordan sygdommen efter al sandsynlighed vil respondere på en given behandling. I daglig praksis tages der en blodprøve fra patienten, og mængden af biomarkøren i blodet måles.
Det skal understreges, at hvis et surrogat-endepunkt skal kunne bruges til regulatoriske formål, skal markøren være bekræftet eller valideret tidligere. Det skal være påvist, at ændringer i biomarkøren korrelerer med (svarer til) det kliniske resultat af en specifik sygdom og behandlingens effekt.
Flere ressourcer
- World Health Organisation (2008). Where are the patients in decision-making about their own care? Retrieved 31 August, 2015, from http://www.who.int/management/general/decisionmaking/WhereArePatientsinDecisionMaking.pdf
A2-1.10-v1.3