Evidence-based medicine
Inleiding
Lisa heeft hevige pijn na een operatie. De arts moet kiezen tussen tabletten (in overeenstemming met extern klinisch bewijs) en injectie (in overeenstemming met persoonlijke klinische ervaring en patiëntvoorkeuren). De arts weet dat volgens extern klinisch bewijs tabletten met morfine de beste keuze zouden zijn. Echter, een veelvoorkomende bijwerking van de anesthesie die Lisa heeft gekregen tijdens de operatie, is braken. Dit betekent dat als Lisa een tablet krijgt en gaat overgeven, de tablet zal worden opgegeven en geen pijnverlichtende werking zal hebben. De arts en Lisa weten uit ervaring dat Lisa waarschijnlijk zal beginnen met overgeven binnen 30 minuten nadat de anesthesie is uitgewerkt. Daarom besluit de arts om Lisa in plaats daarvan een injectie met morfine te geven.
In het voorbeeld besluit de arts, op basis van persoonlijke klinische ervaring en patiëntvoorkeuren, om een morfine-injectie te gebruiken in plaats van tabletten met morfine, die het beste externe klinische bewijs hebben. De arts gebruikt hetzelfde geneeskundige bestanddeel (d.w.z. morfine), zoals voorgesteld in het externe klinische bewijs, maar kiest ervoor om een andere formulering te gebruiken (d.w.z. injectie in plaats van tablet).
Dit is een voorbeeld van hoe een arts tot een specifiek behandelbesluit komt op basis van bewijs gevolgd door een gesprek met een patiënt.
Wat is ‘evidence-based’ geneeskunde?
‘Evidence-based medicine’ (EBM) is het proces van systematische evaluatie, waardebepaling en toepassing van bevindingen uit klinisch onderzoek om zo de beste zorg aan patiënten te kunnen geven. Het is belangrijk dat patiënten kennis hebben van ‘evidence-based medicine’ omdat ze hiermee beter geïnformeerde beslissingen kunnen nemen over het managen en behandelen van ziekte. Het geeft patiënten ook een accuratere perceptie van risico, bevordert correct gebruik van optionele procedures, en ondersteunt ‘evidence-based’ besluitvorming van arts/patiënt.
‘Evidence-based medicine’ is een combinatie van principes en methoden. Wanneer ze worden toegepast zorgen ze ervoor dat medische besluiten, richtlijnen en beleidslijnen zijn gebaseerd op de huidige beste bewijzen met betrekking tot de effecten van diverse behandelvormen en gezondheidszorg in het algemeen. Wat betreft geneesmiddelen leunt het grotendeels op informatie afkomstig uit de evaluatie van baten en risico (werkzaamheid en veiligheid).
Het concept ‘evidence-based medicine’ kwam op in de jaren vijftig van de vorige eeuw. Voor die tijd werden medische besluiten vooral genomen op basis van medische scholing, klinische ervaring en het lezen van vaktijdschriften. Uit onderzoeken bleek echter dat medische behandelbesluiten aanzienlijk varieerden tussen individuele zorgverleners. Er werd een basis gevormd voor de systematische implementatie van methoden om onderzoeksgegevens te verzamelen, evalueren en organiseren – wat leidde tot ‘evidence-based medicine’. Sinds de implementatie is ‘evidence-based medicine’ erkend door artsen, farmaceutische bedrijven, toezichthoudende instanties en het algemene publiek.
De besluitvormer moet kijken naar kennis uit zijn/haar eigen klinische ervaring gecombineerd met het beste bewijs van gecontroleerde klinische studies en wetenschappelijk onderzoek. Het is belangrijk dat klinische ervaring wordt gecombineerd met gecontroleerde klinische studies in de besluitvormingsprocedure. Zonder klinische ervaring kan het risico dat bij een gegeven behandeling hoort uiteindelijk tot ongewenste effecten leiden.
5 stappenmodel van evidence-based medicine
Een van de benaderingen van ‘evidence-based medicine’ is gebaseerd op een 5 stappenmodel:
- Een klinisch relevante vraag definiëren (arts zoekt naar informatie om correcte diagnose te vinden)
- Het beste bewijs zoeken (arts zoekt naar bewijs dat de bevindingen in stap 1 ondersteunt)
- De kwaliteit van het bewijs beoordelen (arts zorgt ervoor dat de kwaliteit en betrouwbaarheid hoog zijn)
- Op grond van het bewijs handelen om tot een klinische beslissing te komen (gebaseerd op stappen 1-3, patiënt en arts nemen gezamenlijk een geïnformeerd behandelbesluit)
- Het proces evalueren (arts en patiënt beoordelen of de bedoelde uitkomst is behaald en stemmen behandelbesluiten daar desgewenst op af)
Wat betreft het voorbeeld in het begin, is de keuze van de arts in lijn met de principes van ‘evidence-based medicine’ plus feedback van de patiënt. Het besluit van de arts behelst consciëntieus, uitdrukkelijk en oordeelkundig gebruik van het beste bewijs op dit moment, met inbegrip van de ervaringen van de patiënt, bij beslissingen over hoe de best mogelijke medische behandeling kan worden gegeven aan een bepaalde patiënt.
Betrokkenheid van de patiënt in het besluitvormingsproces speelt een belangrijke rol voor het vormen van nieuwe richtlijnen omtrent behandelprincipes. Dit behelst lezen en begrijpen van gezondheidsinformatie en daar ook naar handelen; samenwerken met artsen om de juiste behandelopties te evalueren en selecteren; en feedback omtrent de uitkomsten geven. Patiënten kunnen een actieve rol spelen op alle bewijsniveaus.
Bewijs beoordelen voor ‘evidence-based medicine’
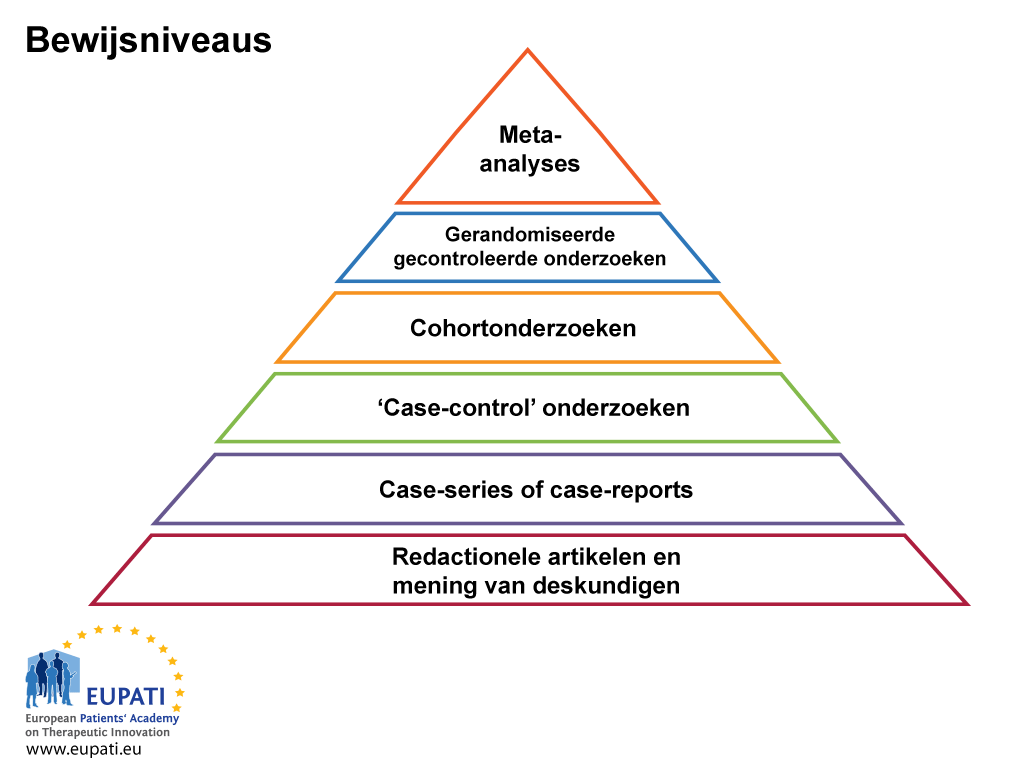
Om de kwaliteit van het bewijs te beoordelen, wordt de verzamelde informatie gerangschikt op verschillende bewijsniveaus. De piramide in de onderstaande figuur vertoont de verschillende bewijsniveaus en hun rangschikking ten opzichte van elkaar.
- De mate van bewijsvoering komt van pas wanneer de kwaliteit van het bewijs moet worden beoordeeld.
Beschrijvingen en ‘expert opinion’ (deskundig advies)
Dit is bewijs gebaseerd op de adviezen van een deskundigenpanel waarmee geprobeerd wordt algemene medische praktijklijnen te vormen.
‘Case-series’ en ‘case-reports’
‘Case-series’ zijn beschrijvende onderzoeken die een kleine groep mensen volgen. Het zijn toevoegingen of aanvullingen bij ‘case-reports’. Een ‘case-report’ is een gedetailleerd verslag van de symptomen, tekenen, diagnose, behandeling en opvolging van een individuele patiënt.
‘Case-control’ onderzoek
Een ‘case-control’ onderzoek is een observationeel retrospectief onderzoek (waarin wordt gekeken naar historische gegevens) waarin patiënten met een ziekte worden vergeleken met patiënten zonder de ziekte. Uitkomsten zoals longkanker worden meestal bestudeerd met behulp van ‘case-control’ onderzoeken. Er wordt een groep rokers (de blootgestelde groep) en een groep niet-rokers (de niet-blootgestelde groep) gerekruteerd en in de loop van de tijd gevolgd. De verschillen in de incidentie (aantal nieuwe gevallen in een bepaalde periode) van longkanker tussen de groepen worden vervolgens gedocumenteerd, waardoor de te beoordelen variabele (de ‘onafhankelijke variabele’ – in dit geval roken) kan worden geïsoleerd als de oorzaak van de ‘afhankelijke variabele’ (in dit geval longkanker).
In dit voorbeeld zou een statistisch significante toename in de incidentie van longkanker in de rokersgroep vergeleken met de niet-rokersgroep worden gezien als bewijs ten gunste van de aanname dat er een causaal verband is tussen roken en longkanker.
Cohortonderzoek
De moderne definitie van een ‘cohort’ in klinische onderzoeken is een groep mensen met gedefinieerde kenmerken die wordt gevolgd om gezondheidsgerelateerde uitkomsten vast te stellen.
Het onderzoek met de naam ‘Framingham Heart Study’ is een voorbeeld van het gebruik van een cohortonderzoek om een epidemiologische vraag te beantwoorden. Het Framingham-onderzoek begon in 1948 en loopt nog steeds. Het doel is de impact van diverse factoren te bestuderen ten aanzien van de incidentie van hartziekten. De vraag die het onderzoek wil beantwoorden is: Hebben factoren zoals hoge bloeddruk, roken, hoog lichaamsgewicht, diabetes, beweging enzovoorts invloed op de ontwikkeling van hartziekten? Om elke blootstelling te onderzoeken (bijvoorbeeld roken) rekruteerden de onderzoekers een cohort rokers (de blootgestelde groep) en een cohort niet-rokers (de niet-blootgestelde groep). De cohorten zouden dan een bepaalde tijd gevolgd worden. Verschillen in incidentie van hartziekten tussen de cohorten aan het einde van die periode worden vervolgens gedocumenteerd. De cohorten worden bij elkaar gezocht in termen van veel andere variabelen, zoals:
- Economische status (bijvoorbeeld opleiding, inkomen, beroep)
- Gezondheidstoestand (bijvoorbeeld de aanwezigheid van andere ziekten)
Dit betekent dat de te beoordelen variabele (de ‘onafhankelijke variabele’ – in dit geval roken) kan worden geïsoleerd als de oorzaak van de ‘afhankelijke variabele’ (in dit geval hartziekte).
Een statistisch significante toename in de incidentie van hartziekte in de rokersgroep vergeleken met de niet-rokersgroep is in dit voorbeeld bewijs ten gunste van de aanname dat er een causaal verband is tussen roken en de ontwikkeling van hartziekte. De bevindingen van de ‘Framingham Heart Study’ hebben, in de loop van de jaren, voldoende bewijs geleverd dat hart- en vaatziekte grotendeels het resultaat is van meetbare en aanpasbare risicofactoren, en dat personen meer controle over de gezondheid van hun hart kunnen krijgen door: kritisch te kijken naar hun eetpatroon en manier van leven en verandering aan te brengen in hun inname van verzadigde vetten en cholesterol en hun rookgewoonten; af te vallen of lichamelijke actief te worden; en hun stressniveaus en bloeddruk te beheersen. Het is grotendeels te danken aan de ‘Framingham Heart Study’ dat we nu goed inzicht hebben in de relatie tussen bepaalde risicofactoren en hartziekte.
Een ander voorbeeld van een cohortonderzoek dat al vele jaren loopt, is de ‘National Child Development Study’ (NCDS), het meest uitgebreide van alle Britse onderzoeken met geboortecohorten. Het grootste onderzoek onder vrouwen is de ‘Nurses Health Study’. Dit onderzoek begon in 1976 en volgt meer dan 120.000 verpleegkundigen. Gegevens uit dit onderzoek zijn voor veel verschillende aandoeningen en uitkomsten geanalyseerd.
Gerandomiseerd klinisch onderzoek
In een gerandomiseerd klinisch onderzoek worden deelnemers door middel van randomisatie ingedeeld in de verschillende armen van het onderzoek. Dit betekent dat de behandelgroepen op basis van willekeur worden gekozen door een formeel systeem en dat elke deelnemer een even grote kans heeft om voor elk van de armen te worden geselecteerd.
Meta-analyse
Met een meta-analyse (een systematische, op statistiek gebaseerde evaluatie waarin resultaten van uiteenlopende maar gerelateerde onderzoeken tegenover en naast elkaar worden geplaatst) wordt geprobeerd patronen, verschillen en andere relaties tussen meerdere onderzoeken te identificeren. Een meta-analyse kan een sterkere conclusie ondersteunen dan een willekeurig individueel onderzoek, maar kan verzwakt zijn vanwege publicatievertekening.
Uitkomstonderzoek
Uitkomstonderzoek is een overkoepelende term zonder vaststaande definitie. Kort gezegd; in een uitkomstonderzoek worden de eindresultaten van medische zorg bestudeerd – de invloed van gezondheidszorg op de gezondheid en het welbevinden van patiënten. Met andere woorden, klinische uitkomstonderzoeken proberen de impact van medische behandeling op een specifieke patiënt of populatie te controleren, begrijpen en verbeteren. Meestal wordt er onderzoek in beschreven dat zich bezighoudt met de doeltreffendheid van interventies op het vlak van de volksgezondheid en gezondheidsdiensten; dat wil zeggen, de resultaten van die diensten.
De aandacht gaat vaak uit naar betrokken individuen – met andere woorden, de klinische eindpunten (eindresultaten) die er het meest toedoen voor de patiënt of populatie. Dergelijke eindpunten zouden kwaliteit van leven of pijngehalte kunnen zijn. Uitkomstonderzoek kan echter ook gericht zijn op de doeltreffendheid van de levering van gezondheidszorg, met maatstaven als kosteneffectiviteit, gezondheidstoestand en ziektelast (de impact van het gezondheidsprobleem).
Het verschil tussen EBM (‘evidence-based medicine’) en uitkomstonderzoek ligt in de focus: Terwijl bij EBM de nadruk ligt op het leveren van de beste zorg voor de patiënt afgaande op klinische bewijzen en ervaringen, ligt de nadruk van uitkomstonderzoek op vooraf gedefinieerde eindpunten. In klinische uitkomstonderzoeken zijn die eindpunten meestal klinisch relevante eindpunten.
| Type eindpunt | Voorbeeld |
|---|---|
| Fysiologische maat (biomarker) | Bloeddruk |
| Klinisch | Hartdruk |
| Symptomen | Hoesten |
| Functioneel en zorg | Meting van functie, bijvoorbeeld in staat zijn om alledaagse taken uit te voeren, beoordelingen inzake kwaliteit van leven |
In uitkomstonderzoek zijn de relevante eindpunten vaak symptomen of functie- en zorgmaten: dingen die belangrijk worden gevonden door de patiënt die de behandeling krijgt. Bijvoorbeeld, een patiënt met een infectie die vervolgens penicilline krijgt, vindt het wellicht belangrijker dat hij/zij geen koorts meer heeft en zich beter voelt dan te weten wat het effect van de penicilline op het werkelijke infectiegehalte is. In dit geval worden de symptomen en hoe de patiënt zich voelt gezien als een directe beoordeling van de gezondheidstoestand van de patiënt – dus de eindpunten waar uitkomstonderzoek zich op zou richten. De patiënt is waarschijnlijk ook geïnteresseerd in de mogelijke bijwerkingen die gepaard gaan met penicilline, plus de kosten van de behandeling. Voor andere ziekten, zoals kanker, is het overlijdensrisico een belangrijke klinische uitkomst die relevant is voor de patiënt.
Wanneer de duur van het onderzoek lang is, kan in uitkomstonderzoeken ook het gebruik van ‘surrogaateindpunt’ zijn opgenomen. Een surrogaateindpunt is wanneer een biomarker wordt gebruikt om een uitkomst te meten – de biomarker fungeert als substituut voor een klinisch werkzaamheidseindpunt. Neem bijvoorbeeld een klinisch onderzoek waarin het effect van penicillinebehandeling wordt gemeten aan de hand van een afname van de hoeveelheid van een bepaald eiwit (het zogeheten ‘C-reactive protein’), dat altijd in het bloed aanwezig is. Bij een gezond persoon is de hoeveelheid van dit eiwit in het bloed zeer klein, maar neemt drastisch toe zodra zich een acute infectie voordoet. Het gehalte van ‘C-reactive protein’ meten is dan ook een indirecte manier om infectie in het lichaam te meten. In dit geval dient het eiwit als een ‘biomarker’ voor infectie. Een biomarker is een meetbare indicator van een ziektetoestand. Dit correleert dan weer met het risico of de progressie van de ziekte, of met hoe de ziekte waarschijnlijk zal reageren op een bepaalde behandeling. In de dagelijkse praktijk wordt een bloedmonster genomen van de patiënt, en wordt de hoeveelheid van de biomarker in het bloed gemeten.
Hierbij dient te worden benadrukt dat de marker eerder moet zijn bevestigd of gevalideerd wanneer het gaat om een surrogaateindpunt dat voor regulatoire doeleinden wordt gebruikt. Er moet zijn aangetoond dat de veranderingen in de biomarker correleren (overeenkomen) met de klinische uitkomst van een specifieke ziekte en het effect van een behandeling.
Overige informatiebronnen
- Wereldgezondheidsorganisatie (2008). Where are the patients in decision-making about their own care? Geraadpleegd op 31 augustus 2015 op http://www.who.int/management/general/decisionmaking/WhereArePatientsinDecisionMaking.pdf
A2-1.10-v1.2