Een geneesmiddel maken. Stap 8: Bevestigingsonderzoeken
Inleiding
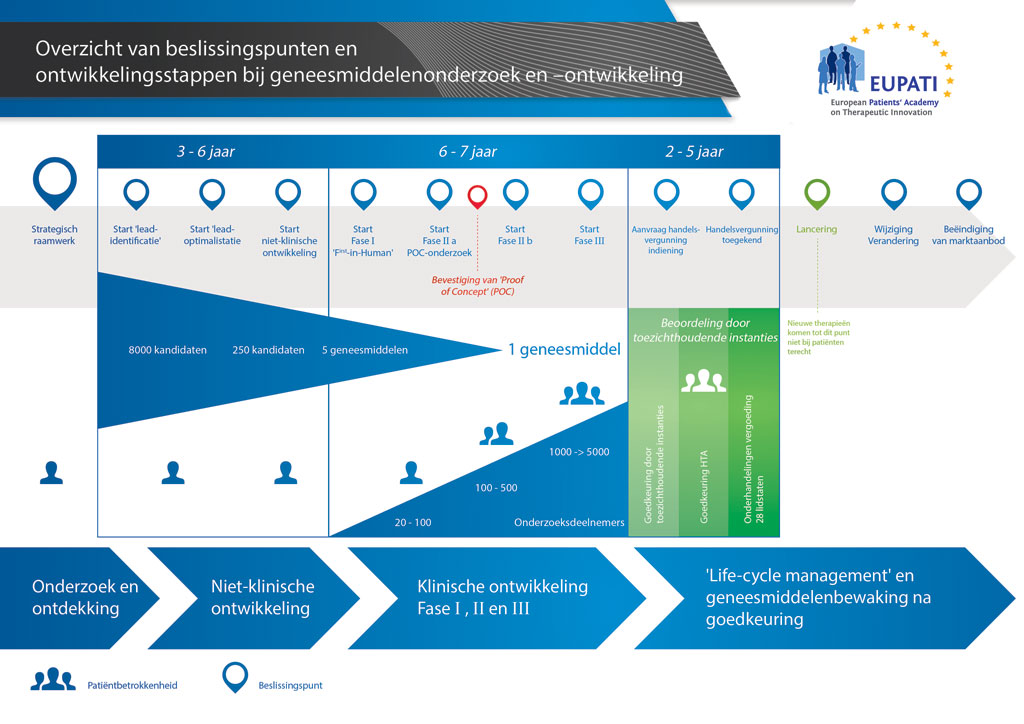
Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt.
Geneesmiddelenontwikkeling is een risicovolle onderneming. De meeste stoffen (ongeveer 98%) die worden ontwikkeld, halen de markt niet als nieuw geneesmiddel. Dit komt voornamelijk doordat de voordelen en risico’s (negatieve bijwerkingen) die tijdens de ontwikkeling worden geconstateerd, zich slecht verhouden tot geneesmiddelen die al verkrijgbaar zijn voor patiënten.
De ontwikkeling van een nieuw geneesmiddel kan worden onderverdeeld in 10 verschillende stappen. Het volgende artikel gaat over Stap 8: Bevestigingsonderzoeken.
- Er kunnen meer dan 10 jaar aan nauwkeurig plannen en onderzoek nodig zijn om een geneesmiddel te ontwikkelen van een molecuul tot een verkoopbare behandeling.
Stap 8: Ontwikkeling voor het in de handel brengen: Fase III-klinische onderzoeken – Bevestigingsonderzoeken
Fase III-onderzoeken (ook wel bevestigingsonderzoeken genoemd) vormen het grootste, ingewikkeldste en duurste onderdeel in de ontwikkeling van een geneesmiddel. Ze hebben tot doel de werkzaamheid en veiligheid van een kandidaat-stof in een grote patiëntenpopulatie te bevestigen.
De beslissing om door te gaan naar klinische onderzoeken van fase III wordt alleen genomen als deze wordt ondersteund door alle informatie uit eerdere onderzoeken, en door productie- en bedrijfseenheden. Het ontwerp van dergelijke onderzoeken is ook zeer belangrijk. Daarom zijn er, voordat de onderzoeken van fase III beginnen, heel veel gesprekken met externe deskundigen, toezichthoudende instanties, patiëntgroepen en anderen. Dit waarborgt dat de juiste vragen worden gesteld en de juiste informatie wordt verzameld. Het aantal patiënten in het onderzoek is ook zeer belangrijk om ervoor te zorgen dat de resultaten correct kunnen worden geïnterpreteerd en zullen voldoen aan de eisen van de toezichthoudende instanties.
Alle verzamelde informatie uit de eerdere stadia wordt gebruikt voor het nemen van belangrijke beslissingen, over:
- de uiteindelijke formulering van het geneesmiddel (hoe het werkzame geneesmiddel wordt gecombineerd met andere chemische stoffen)
- welke dosis wordt getest
- welke patiënten kunnen worden gerekruteerd (inclusiecriteria)
- welke patiënten niet kunnen worden gerekruteerd (exclusiecriteria)
- hoeveel patiënten nodig zijn
- de onderzoeksopzet
- de duur van het onderzoek:
- hoe werkzaamheid en veiligheid worden gemeten
- welke statistische toetsen worden toegepast
In dit stadium kunnen de klinische onderzoeken duizenden patiënten behelzen. Dit hangt echter af van wat het geneesmiddel wordt geacht te behandelen (de ‘indicatie’). Fase III-onderzoeken kunnen bijvoorbeeld in kleinere populaties worden uitgevoerd als de indicatie een aandoening is die niet vaak voorkomt.
Fase III-onderzoeken kunnen duizenden patiënten behelzen, in meerdere landen worden gedaan en enorm veel deskundigheid vereisen om effectief te worden uitgevoerd. Ze zijn dan ook zeer duur en tijdrovend. Maar dit is de enige manier om een helder beeld te krijgen van de relatie tussen de werkzaamheid van het geneesmiddel (of het werkt) en de veiligheid ervan (of het goed wordt verdragen), wat zeer belangrijk is.
Fase III-onderzoeken vormen het grootste, ingewikkeldste en duurste onderdeel in het proces van geneesmiddelontwikkeling. Meer dan 50% van de geneesmiddelen faalt in deze stap. Het faalpercentage van projecten die in het ontdekkingsstadium beginnen is meer dan 97%. De opbrengst van de paar geneesmiddelen die het tot de markt halen, dekt de kosten van alle projecten, zowel de mislukte als de geslaagde projecten.
Referenties
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bijlagen
- Factsheet: Bevestigingsonderzoekena
Size: 104,027 bytes, Format: .docx
Dit factsheet gaat over klinische onderzoeken in fase III, wat de langste, ingewikkeldste en duurste onderzoeken zijn in het proces van geneesmiddelenontwikkeling.
- Presentatie: De basisprincipes van geneesmiddelontdekking en -ontwikkeling
Size: 950,426 bytes, Format: .pptx
De basisprincipes van geneesmiddelontdekking en -ontwikkeling. Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt. Deze presentatie gaat nader in op het proces van ontdekking tot marktintroductie van een nieuw geneesmiddel en daarna.
A2-1.02.7-v1.1