Een geneesmiddel maken. Stap 7: Fase II – Proof of concept
Inleiding
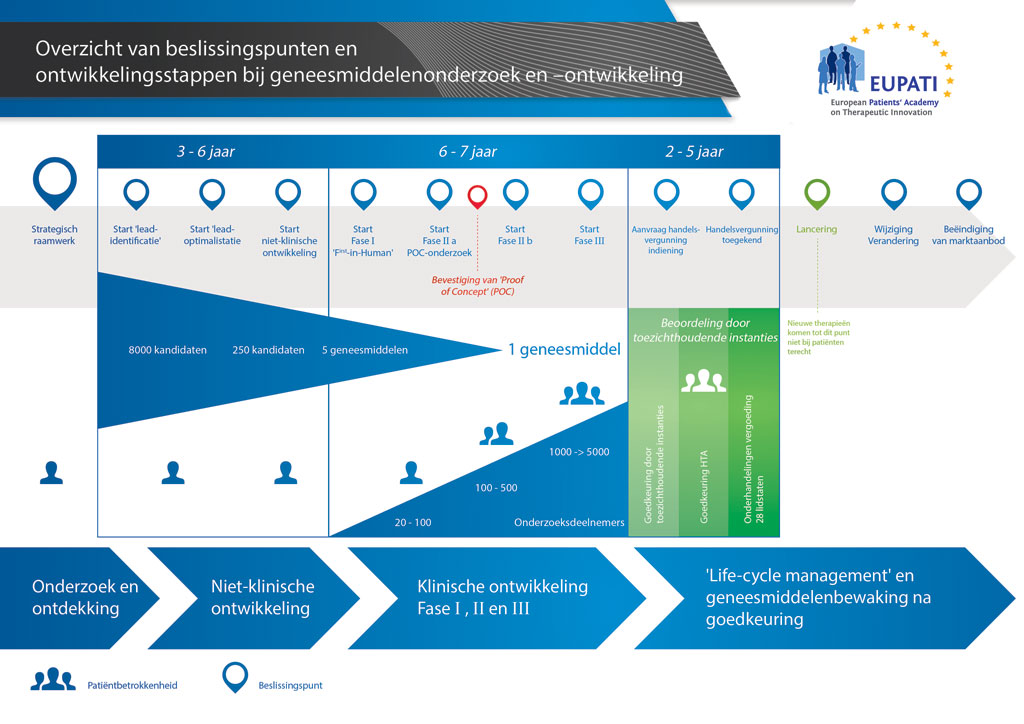
Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt.
Geneesmiddelenontwikkeling is een risicovolle onderneming. De meeste stoffen (ongeveer 98%) die worden ontwikkeld, halen de markt niet als nieuw geneesmiddel. Dit komt voornamelijk doordat de voordelen en risico’s (negatieve bijwerkingen) die tijdens de ontwikkeling worden geconstateerd, zich slecht verhouden tot geneesmiddelen die al verkrijgbaar zijn voor patiënten.
De ontwikkeling van een nieuw geneesmiddel kan worden onderverdeeld in 10 verschillende stappen. Het volgende artikel gaat over Stap 7: Proof of concept – Klinische onderzoeken in Fase II.
- Er kunnen meer dan 10 jaar aan nauwkeurig plannen en onderzoek nodig zijn om een geneesmiddel te ontwikkelen van een molecuul tot een verkoopbare behandeling.
Stap 7: Proof of concept – Klinische onderzoeken in Fase II
Klinische onderzoeken met patiënten. Als de resultaten van onderzoeken met vrijwilligers hebben aangetoond dat het veilig is om door te gaan, is de volgende stap het starten van klinische onderzoeken met patiënten die de ziekte hebben die wordt behandeld. In deze klinische onderzoeken gelden dezelfde richtlijnen en voorschriften als in de klinische onderzoeken van Fase I.
Er zijn meestal twee behandelgroepen in Fase II- en Fase III-onderzoeken. De ene groep heeft het werkzame geneesmiddel en de andere groep ontvangt de beste huidige behandeling, of een nepgeneesmiddel dat geen effect heeft op het lichaam (een zogeheten ‘placebo’). Deze onderzoeken worden meestal uitgevoerd als ‘dubbelblinde’, ‘gerandomiseerde’ onderzoeken.
- ‘Dubbelblind’ wil zeggen dat noch de arts noch de deelnemer weet wie het werkzame geneesmiddel en wie het beste huidige geneesmiddel danwel de placebo krijgt.
- ‘Gerandomiseerd’ wil zeggen dat de behandelgroepen op basis van willekeur worden gekozen. Dit wordt meestal gedaan met een computer die een willekeurige code genereert. Dit kan niet worden beïnvloed door de arts of iemand anders.
- ‘Placebo-gecontroleerd’ wil zeggen dat sommige deelnemers een placebo krijgen die wordt gegeven onder exact dezelfde omstandigheden als het werkzame geneesmiddel. Hierdoor kunnen de effecten die worden veroorzaakt door het geneesmiddel, worden afgezonderd. Als een deelnemer in een onderzoek bijvoorbeeld over hoofdpijn klaagt, is het belangrijk om te weten of dit wordt veroorzaakt door het werkzame geneesmiddel. Als net zo veel deelnemers die placebo krijgen over hoofdpijn klagen, is hiermee aangetoond dat de hoofdpijn niet alleen door het werkzame geneesmiddel kan worden veroorzaakt.
Alle gedetailleerde informatie over het klinische onderzoek staat beschreven in het onderzoeksprotocol en de informatie wordt verzameld op het ‘case report form’ (CRF of casus rapportage formulier). De resultaten worden vervolgens geanalyseerd met behulp van statistische toetsen.
Deze klinische onderzoeken worden meestal uitgevoerd met 100 tot 500 patiënten. Ze zijn ontworpen om informatie te verkrijgen over het effect van het geneesmiddel op de betreffende ziekte (‘proof of concept’). Dit is ook het stadium waarin verschillende doses van het geneesmiddel worden gebruikt om erachter te komen wat de beste dosis is. Deze dosis wordt dan gebruikt in de volgende fase van grotere klinische onderzoeken.
Hoe meer kan worden geleerd over het effect bij de patiënten in dit stadium, hoe eenvoudiger het is om te beslissen of de ontwikkeling van de kandidaat-stof vervolgd moet worden. Fase II-onderzoeken zijn echter te klein om voldoende bewijs te kunnen verschaffen over werkzaamheid en veiligheid. Daarom is het belangrijk dat steeds meer informatie wordt verzameld over hoe het geneesmiddel werkt bij patiënten om het risico op mislukken in het volgende stadium te verkleinen. Dit is Fase III of ‘ontwikkeling voor het in de handel brengen’. Dit is de ingewikkeldste en duurste fase in de ontwikkeling.
Omdat deze Fase II-onderzoeken worden gedaan met patiënten, worden de onderzoeken meestal uitgevoerd op verschillende ziekenhuislocaties door artsen in het ziekenhuis (onderzoekers genaamd) in tegenstelling tot Fase I-onderzoeken, die meestal worden uitgevoerd op speciale afdelingen.
Het uitvoeren van klinische onderzoeken op verschillende locaties tegelijkertijd is ingewikkelder dan het uitvoeren van een klinisch onderzoek op één enkele locatie:
- Alle onderzoekers en onderzoeksverpleegkundigen moeten geschoold zijn om een vastgesteld protocol te hanteren zodat het onderzoek op alle locaties op dezelfde manier wordt uitgevoerd.
- Het geneesmiddel moet naar verschillende landen worden geëxporteerd en correct worden bewaard in verschillende apotheken.
- De bloedmonsters die bij de patiënten worden afgenomen in het klinische onderzoek, worden meestal naar één centraal laboratorium gestuurd.
- Alle lokale regels en voorschriften in landen moeten bekend zijn en worden nageleefd.
- Meestal is in elk land advies van een ethische commissie en goedkeuring van de bevoegde autoriteit vereist.
Al deze activiteiten moeten worden gecoördineerd door het mondiale onderzoeksteam.
Samenvatting: Stappen 1-7
Aan het einde van de Fase II-onderzoeken is aan het programma:
- gemiddeld 8,5 jaar besteed, En
- gemiddeld 1 miljard euro uitgegeven.
Van elke 10 geneesmiddelen die in Fase I en Fase II worden getest, zullen er (gemiddeld) slechts twee doorgaan naar de volgende fase.
Referenties
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford: Wiley-Blackwell.
Bijlagen
- Factsheet (feitenoverzicht): Proof of concept
Size: 96,562 bytes, Format: .docx
Deze factsheet gaat over de klinische onderzoeken in Fase II – of ‘proof of concept-onderzoeken. Deze onderzoeken worden uitgevoerd met een klein aantal patiënten die de doelziekte hebben, om er zeker van te zijn dat de kandidaat-stof effect heeft op de ziekte.
- Presentatie: De basisprincipes van geneesmiddelontdekking en -ontwikkeling
Size: 950,426 bytes, Format: .pptx
De basisprincipes van geneesmiddelontdekking en -ontwikkeling. Gemiddeld duurt het ruim 12 jaar en kost het meer dan 1 miljard euro om al het benodigde onderzoeks- en ontwikkelingswerk te doen voordat een nieuw geneesmiddel beschikbaar komt om door patiënten te worden gebruikt. Deze presentatie gaat nader in op het proces van ontdekking tot marktintroductie van een nieuw geneesmiddel en daarna.
A2-1.02.6-v1.1