Biotilgængelighed og bioækvivalens
Biotilgængelighed
Biotilgængelighed er defineret som: brøkdelen (procentdelen) af en indgivet dosis lægemiddel, der uomdannet når frem til blodbanen (systemisk cirkulation).
I alle tilfælde er det meningen ved brug af et lægemiddel, at det aktive stof i lægemidlet – også kaldet den “aktive farmaceutiske ingrediens” – skal trænge ind i kroppen. For at have en terapeutisk effekt er det dog ikke nok, at det aktive stof blot kommer ind i kroppen. Det aktive stof skal være tilgængeligt i den korrekte dosis på det specifikke sted i kroppen, hvor det skal virke. Det specifikke sted kaldes “målstedet”. Det aktive stof skal nå frem til målstedet inden for et bestemt tidsrum og være tilgængeligt der i en defineret periode.
Når der gives en indsprøjtning direkte i blodet, dvs. en intravenøs indsprøjtning (IV), defineres biotilgængeligheden som 100 % (se figuren nedenfor).
Efter indsprøjtningen når et aktivt stof frem til målstedet efter en kompleks rejse gennem blodet. Ved evaluering af biotilgængelighed indsamles der blodprøver, og koncentrationen af det aktive stof i blodet (systemisk cirkulation) bestemmes. Biotilgængeligheden vil således være 100 % lige efter indsprøjtningen, da det aktive stof indgives direkte i blodet. Dette kan ses på Y-aksen i figuren ovenfor (intravenøs biotilgængelighed). Hvis 75 milligram (mg) at det aktive stof sprøjtes ind i blodet, svarer 100 % således til 75 mg aktivt stof.
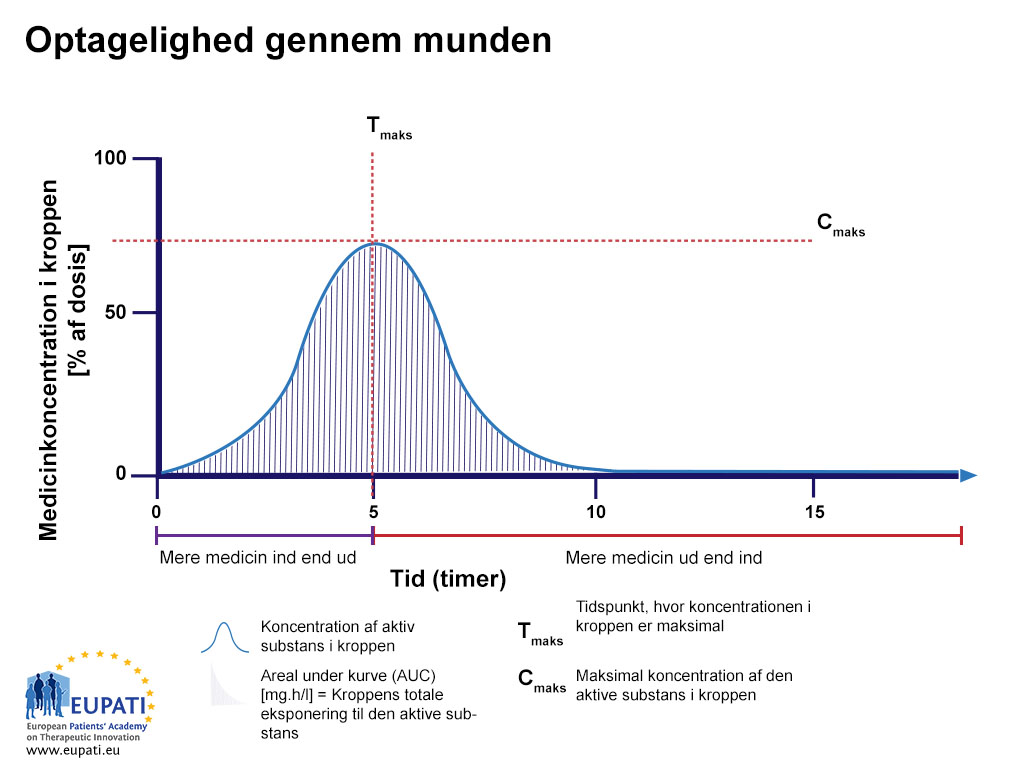
Når det aktive stof cirkulerer via blodet, vil en del af det aktive stof blive omdannet eller udskilt, og koncentrationen af det aktive stof i kroppen vil derfor blive mindre over tid (se figuren ovenfor). Biotilgængelighedsprofilen kan evalueres og sammenlignes med andre lægemidler ved at se på arealet under kurven (AUC), som repræsenterer den samlede eksponering over for det aktive stof, som kommer ind i kroppen. Det tidspunkt, hvor den højeste koncentration af det aktive stof findes i blodet, kaldes Tmax,, og den maksimale koncentration af det aktive stof, der findes i blodet, kaldes Cmax.
Hvis det samme aktive stof, som vises i figuren ovenfor, gives via en anden vej, f.eks. som tablet, der indgives oralt (via munden), er biotilgængeligheden under 100 % (se figuren nedenfor, Oral biotilgængelighed).
- Procentdelen af aktivt stof, efter en tablet er blevet slugt, undersøgt i en periode på 15 timer. Arealet under kurven er skraveret og repræsenterer den samlede mængde aktivt stof, som var i blodet i løbet af den undersøgte periode. Tmax er det tidspunkt, hvor den højeste koncentration af lægemidlet findes i blodet, hvorimod Cmax er den maksimale koncentration af lægemidlet, som findes i blodet.
Oral biotilgængelighed
Procentdelen af aktivt stof, efter en tablet er blevet slugt, undersøgt i en periode på 15 timer. Arealet under kurven er skraveret. Tmax er det tidspunkt, hvor den højeste koncentration af lægemidlet findes i blodet, hvorimod Cmax er den maksimale koncentration af lægemidlet, som findes i blodet.
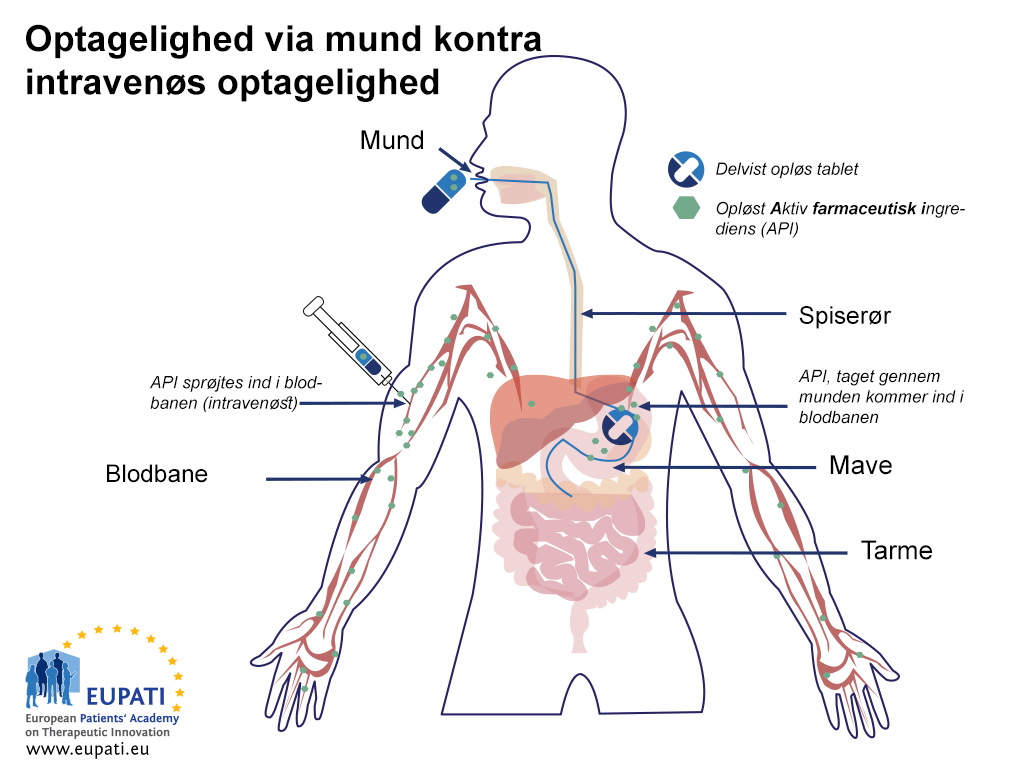
Den lavere biotilgængelighed ved den orale vej sammenlignet med intravenøs indsprøjtning forklares i figuren nedenfor (Oral ift. intravenøs biotilgængelighed):
- Sammenligning af biotilgængeligheden for aktive farmaceutiske ingredienser, der indgives oralt og intravenøst. Det siges, at en aktiv farmaceutisk ingrediens er “biologisk tilgængelig” (biotilgængelig), når den kommer ind i blodet.
Efter en tablet eller kapsel er blevet slugt, når det ned i maven inden for et eller to minutter.1 I maven opløses tabletten eller kapslen, og noget af det aktive stof absorberes i blodet. Komponenterne transporteres til tyndtarmen, hvor absorptionen fuldføres. Absorptionen fra det gastrointestinale system kan variere markant. Dårlig eller manglende absorption fra maven og tarmene kan resultere i lavere biotilgængelighed, så dette er en vigtigt proces, der kan påvirke tilgængeligheden.
Når det aktive stof absorberes, sker det til den hepatiske portvene og transporteres derefter til leveren. Det er første gang, det aktive stof metaboliseres i leveren, hvilket kaldes "førstepassage-metabolisme". Nogle aktive stoffer metaboliseres i højere grad end andre under denne førstepassage-metabolisme. Den ikke-metaboliserede del af det aktive stof, hvilket normalt er mindre end 100 %, når den systematiske cirkulation via den hepatiske vene. Den mængde, der rent faktisk når den systemiske cirkulation, kaldes den "absolutte biotilgængelighed".
Absolut biotilgængelighed sammenligner biotilgængeligheden for den aktive farmaceutiske ingrediens i systemisk cirkulation efter ikke-intravenøs indgivning med biotilgængeligheden for det samme lægemiddel efter intravenøs indgivning. Det er procentdelen af den aktive farmaceutiske ingrediens, der er absorberet via ikke-intravenøs indgivning, sammenlignet med den tilsvarende mængde af det samme lægemiddel, der er indgivet intravenøst.
I absolut biotilgængelighed er standarden altid IV.
Relativ biotilgængelighed måler biotilgængeligheden for en formel (A) for et bestemt lægemiddel sammenlignet med en anden formel (B) af det samme lægemiddel, normalt en anden etableret standard end IV eller gennem indgivning via en anden administrationsvej.
Biotilgængelighed påvirkes af en række andre faktorer, som er forskellige for hver enkelt person. Se det vedhæftede faktaark for at få vist nogle eksempler på biotilgængelighed.
Bioækvivalens
Bioækvivalens er forholdet mellem to præparater af det samme lægemiddel i samme doseringsform, der har en lignende biotilgængelighed.
Den relative biotilgængelighed bruges ikke kun til at sammenligne forskellige formler, men også når to tabletter (eller andre lægemidler med samme formel) med samme aktive stof fra forskellige medicinalvirksomheder skal sammenlignes. Tabletten fra virksomhed A kaldes et generisk lægemiddel i forhold til referencetabletten fra virksomhed B (varemærkelægemiddel). For at se, om tablet A er bioækvivalent med tablet B, sammenlignes biotilgængelighedsraterne for de to tabletter.2
Flere ressourcer
- Food and Drug Administration (2002). Guidance for industry: Bioavailability and bioequivalence studies for orally administered drug products – General considerations. Rockville, MD: Food and Drug Administration. Retrieved 23 June, 2015, from http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM154838.pdf
- Wang, H., Li, Q., Reyes, S., Zhang, J., Xie, L., Melendez, V., Hickman, M. og Kozar, M.P. (2013). Formulation and particle size reduction improve bioavailability of poorly water-soluble compounds with antimalarial activity. Malaria Research and Treatment, Retrieved June 23, 2015, from http://dx.doi.org/10.1155/2013/769234
- Johnson, J.A. (2000). Predictability of the effects of race or ethnicity on pharmacokinetics of drugs. International Journal of Clinical Pharmacology and Therapeutics, 38, 53-60.
Referencer
- Tatum, R.P., Shi, G., Manka, M.A., Brasseur, J.G., Joehl, R.J. and Kahrilas, P.J. (2000). Bolus transit assessed by an esophageal stress test in postfundoplication dysphagia. Journal of Surgical Research, 91, 56–60.
- MobiSystems, Inc. (2007). Dorland's Medical Dictionary for Health Consumers. [Mobile application software].
Bilag
A2-1.16-V1.2