Biologische beschikbaarheid/bio-equivalentie
Biologische beschikbaarheid
Biologische beschikbaarheid wordt gedefinieerd als: de fractie (het percentage) van een toegediende dosis van een geneesmiddel dat onveranderd de bloedbaan (systemische circulatie) bereikt.
Wanneer we een geneesmiddel gebruiken willen we dat de werkzame stof van het geneesmiddel, ook wel aangeduid als de ‘actieve farmaceutische stof’, het lichaam kan binnenkomen. Maar om een therapeutisch effect te hebben is het niet voldoende dat de werkzame stof het lichaam binnenkomt. De werkzame stof moet in de juiste dosis beschikbaar zijn op de specifieke locatie in het lichaam waar het zijn werk moet doen. Deze specifieke locatie wordt aangeduid als doellocatie of ‘target’. Ook moet de werkzame stof de doellocatie binnen een bepaalde tijd bereiken en daar gedurende een vastgestelde periode aanwezig zijn.
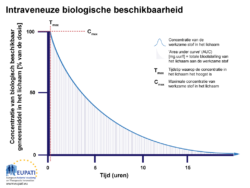
Wanneer een injectie rechtstreeks in de bloedbaan wordt gegeven, dus een intraveneuze (i.v.) injectie, wordt de biologische beschikbaarheid gedefinieerd als 100% (zie onderstaande figuur).
- Het percentage van de werkzame stof in het lichaam van de biologische beschikbaarheid, na rechtstreekse injectie in de bloedbaan, bestudeerd gedurende een periode van 15 uur. De oppervlakte onder de curve (AUC) is ingekleurd. Tmax is het moment waarop de hoogste concentratie van het geneesmiddel in de bloedbaan wordt gevonden; Cmax is de maximale concentratie van het geneesmiddel die in het bloed wordt gevonden.
Na injectie bereikt een werkzame stof de doellocatie na een complexe reis in de bloedbaan. Voor evaluatie van de biologische beschikbaarheid worden bloedmonsters afgenomen, en wordt de concentratie van de werkzame stof in het bloed (de systemische circulatie) bepaald. De biologische beschikbaarheid zal dus vlak na de injectie 100% zijn, want de werkzame stof wordt rechtstreeks in het bloed toegediend. Dit is precies wat u op de Y-as in bovenstaande figuur ziet (intraveneuze biologische beschikbaarheid). Dus als >75% milligram (mg) werkzame stof in de bloedbaan wordt geïnjecteerd, komt 100% overeen met >75% mg werkzame stof.
Wanneer de werkzame stof via de bloedbaan circuleert, wordt een fractie (deel) van de werkzame stof gemetaboliseerd of uitgescheiden, en de concentratie van de werkzame stof in het lichaam neemt dus mettertijd af (zie figuur hierboven). Het biologische beschikbaarheids- of werkzame profiel wordt beoordeeld en vergeleken met andere geneesmiddelen door naar de oppervlakte onder de curve (area under the curve, AUC) te kijken, die de totale blootstelling van het lichaam aan een werkzame stof weergeeft. Het moment waarop de hoogste concentratie van de werkzame stof in het bloed wordt gevonden, noemen we Tmax, en de hoogste concentratie van de werkzame stof die in de bloedbaan wordt gevonden, noemen we Cmax.
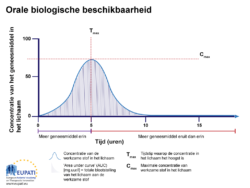
Als dezelfde werkzame stof uit bovenstaande figuur via een andere weg wordt toegediend, bijvoorbeeld een oraal (via de mond) gegeven tablet is de biologische beschikbaarheid minder dan 100% (zie onderstaande figuur, orale biologische beschikbaarheid).
- Het percentage van een werkzame stof nadat een tablet is doorgeslikt, bestudeerd gedurende een periode van 15 uur. De AUC is ingekleurd. Tmax is het moment waarop de hoogste concentratie van het geneesmiddel in de bloedbaan wordt gevonden, terwijl Cmax de maximale concentratie van het geneesmiddel is die in het bloed wordt gevonden.
Orale biologische beschikbaarheid
Het percentage van een werkzame stof nadat een tablet is doorgeslikt, bestudeerd gedurende een periode van 15 uur. De AUC is ingekleurd. Tmax is het moment waarop de hoogste concentratie van het geneesmiddel in de bloedbaan wordt gevonden, terwijl Cmax de hoogste concentratie van het geneesmiddel in de bloedbaan is.
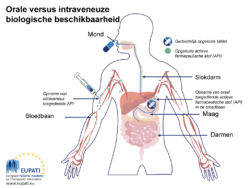
De lagere biologische beschikbaarheid van de orale route vergeleken met intraveneuze injectie wordt in de figuur hieronder uitgelegd (orale versus intraveneuze biologische beschikbaarheid):
- Schematische illustratie van de absorptie van een oraal ingenomen capsule versus een injectie rechtstreeks in de bloedbaan (intraveneuze injectie). Na aankomst in de maag wordt de capsule verder getransporteerd naar de dunne darm waar verdere absorptie plaatsvindt.
Nadat een tablet of capsule is doorgeslikt, bereikt het binnen een minuut of twee de maag.1 In de maag lost de tablet of capsule op, en een deel van de werkzame stof wordt in de bloedbaan opgenomen. De componenten worden naar de dunne darm getransporteerd waar de absorptie wordt voltooid. Absorptie in het maag-darmstelsel kan behoorlijk variëren. Lagere biologische beschikbaarheid kan het resultaat zijn van weinig of geen absorptie in de maag en de darmen, dus dit is een belangrijke stap die de beschikbaarheid kan beïnvloeden.
Wanneer de werkzame stof is geabsorbeerd komt het bij de leverpoortader, en wordt het naar de lever getransporteerd. Dit is de eerste keer dat de werkzame stof wordt gemetaboliseerd in de lever, en dit wordt ‘eerste leverpassage’ genoemd. Sommige werkzame stoffen worden tijdens deze eerste stofwisseling in hogere mate gemetaboliseerd dan andere stoffen. Het niet gemetaboliseerde deel van de werkzame stof, normaal gesproken minder dan 100%, komt via de leverader in de systemische circulatie terecht. De hoeveelheid die daadwerkelijk de systemische circulatie bereikt wordt aangeduid als de ‘absolute biologische beschikbaarheid’.
Absolute biologische beschikbaarheid vergelijkt de biologische beschikbaarheid van de actieve farmaceutische stof in de systemische circulatie na niet-intraveneuze toediening met de biologische beschikbaarheid van hetzelfde geneesmiddel na intraveneuze toediening. Het is het percentage van de actieve farmaceutische stof niet-intraveneus toegediend vergeleken met hetzelfde geneesmiddel intraveneus toegediend.
Kortom, bij absolute biologische beschikbaarheid is de standaard altijd i.v.
Relatieve biologische beschikbaarheid meet de biologische beschikbaarheid van een formulering (A) van een bepaald geneesmiddel wanneer dit wordt vergeleken met een andere formulering (B) van hetzelfde geneesmiddel, meestal een gebruikelijke standaardbehandeling anders dan intraveneus, of toediening via een andere weg.
Biologische beschikbaarheid wordt beïnvloed door diverse andere factoren, die per persoon verschillen. In het bijgevoegde factsheet worden enkele voorbeelden gegeven van biologische beschikbaarheid.
Bio-equivalentie
Bio-equivalentie is de relatie tussen twee bereidingen van hetzelfde geneesmiddel in dezelfde dosis met een vergelijkbare biologische beschikbaarheid.
De relatieve biologische beschikbaarheid wordt niet alleen gebruikt om verschillende samenstellingen te vergelijken, maar ook wanneer twee tabletten (of wat voor geneesmiddelen dan ook met dezelfde samenstelling) met dezelfde werkzame stof van verschillende farmaceutische bedrijven moeten worden vergeleken. De tablet van bedrijf A wordt aangeduid als het generieke geneesmiddel ten opzichte van de referentietablet van bedrijf B (merkgeneesmiddel). Om te zien of tablet A bio-equivalent is aan tablet B worden de biologische beschikbaarheidspercentages van de twee vergeleken.2
Overige informatiebronnen
- Food and Drug Administation (2002). Guidance for industry: Bioavailability and bioequivalence studies for orally administered drug products – General considerations. Rockville, MD: Food and Drug Administration. Geraadpleegd op 23 juni 2015 op http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM154838.pdf
- Wang, H., Li, Q., Reyes, S., Zhang, J., Xie, L., Melendez, V., Hickman, M. and Kozar, M.P. (2013). Formulation and particle size reduction improve bioavailability of poorly water-soluble compounds with antimalarial activity. Malaria Research and Treatment, Geraadpleegd op 23 juni 2015 op http://dx.doi.org/10.1155/2013/769234
- Johnson, J.A. (2000). Predictability of the effects of race or ethnicity on pharmacokinetics of drugs. International Journal of Clinical Pharmacology and Therapeutics, 38, 53-60.
Referenties
- Tatum, R.P., Shi, G., Manka, M.A., Brasseur, J.G., Joehl, R.J. and Kahrilas, P.J. (2000). Bolus transit assessed by an esophageal stress test in postfundoplication dysphagia. Journal of Surgical Research, 91, 56–60.
- MobiSystems, Inc. (2007). Dorland's Medical Dictionary for Health Consumers. [Mobile application software].
Bijlagen
- Factsheet: Voorbeelden van biologische beschikbaarheid
Size: 110,012 bytes, Format: .docx
Voorbeelden van biologische beschikbaarheid met betrekking tot penicilline en astma.
A2-1.16-V1.2