Biodisponibilità e bioequivalenza
Biodisponibilità
Viene definita biodisponibilità la frazione (percentuale) di una dose somministrata di farmaco non modificato che raggiunge il flusso sanguigno (circolazione sistemica).
In tutti i casi, quando si utilizza un medicinale, è necessario che la sostanza attiva del farmaco, chiamata anche principio attivo (API, active pharmaceutical ingredient), entri nell’organismo. Tuttavia, al fine di ottenere un effetto terapeutico, non è sufficiente che avvenga questo. Il principio attivo deve essere disponibile nella dose corretta sul sito specifico nell’organismo in cui deve agire. Il sito specifico si chiama “sito bersaglio”. Il principio attivo deve inoltre raggiungere il sito bersaglio entro un determinato tempo ed essere disponibile sul sito stesso per una durata definita.
Quando si somministra un’iniezione direttamente nel flusso sanguigno, ad esempio un’iniezione endovenosa (IV, intravenous), la biodisponibilità viene definita del 100% (vedere il diagramma sotto).
- La percentuale di principio attivo nel corpo o biodisponibilità, dopo iniezione diretta nel flusso sanguigno, studiata per un periodo di 15 ore. L’area sotto la curva (AUC) è ombreggiata. Tmax è il momento in cui si riscontra la massima concentrazione di farmaco nel sangue mentre Cmax è la massima concentrazione di farmaco rilevata nel sangue.
Con l'iniezione, un principio attivo raggiunge il sito bersaglio dopo un complesso percorso nel flusso sanguigno. Quando si misura la biodisponibilità, vengono raccolti campioni di sangue e viene determinata la concentrazione del principio attivo nel sangue (circolazione sistemica). Di conseguenza, la biodisponibilità sarà del 100% subito dopo l'iniezione, quando il principio attivo viene somministrato direttamente nel sangue. Questo è esattamente ciò che si osserva sull'asse y nel diagramma sopra ("Biodisponibilità endovenosa"). Quindi, se nel flusso sanguigno vengono iniettati 75 milligrammi (mg) di principio attivo, il 100% equivale allora a tali 75 mg.
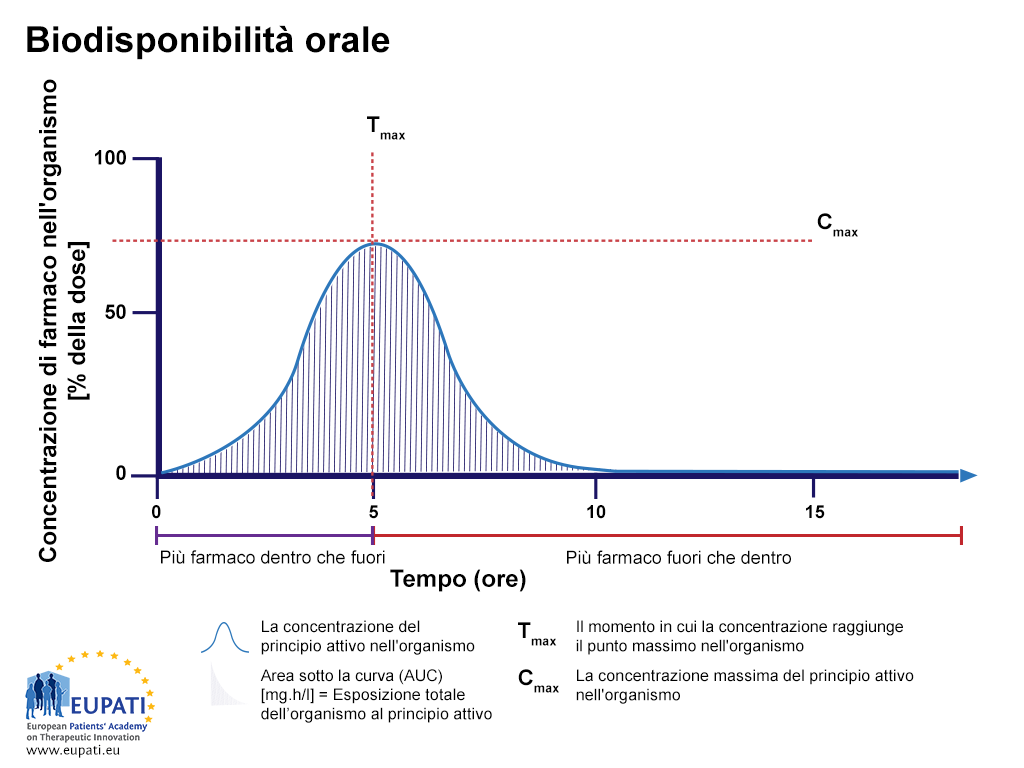
Quando il principio attivo circola nel flusso sanguigno, una frazione di esso verrà metabolizzata o escreta, e conseguentemente la concentrazione di principio attivo nell'organismo diminuirà nel corso del tempo (vedere il diagramma sotto). Il profilo della biodisponibilità viene analizzato e confrontato con quello di altri farmaci osservando l'area sotto la curva (AUC, area under the curve) che raffigura l'esposizione al principio attivo assunto dall'organismo. Il momento in cui si riscontra la massima concentrazione di principio attivo nel sangue si chiama Tmax, e la concentrazione massima di principio attivo rilevata nel flusso sanguigno si chiama Cmax.
Se lo stesso principio attivo mostrato nel diagramma sopra viene fornito tramite un'altra modalità, come una compressa somministrata oralmente (per bocca), la biodisponibilità è inferiore al 100% (vedere il diagramma sotto, "Biodisponibilità orale").
- La percentuale di farmaco attivo dopo che una compressa viene inghiottita, studiata per un periodo di 15 ore. AUC è la parte colorata. Il momento in cui si riscontra la massima concentrazione di farmaco nel flusso sanguigno si chiama Tmax, mentre la concentrazione massima di farmaco rilevata nel flusso sanguigno si chiama Cmax.
Biodisponibilità orale
La percentuale di farmaco attivo dopo che una compressa viene deglutita, studiata in un periodo di 15 ore. L'AUC è la parte colorata. Il momento in cui si riscontra la massima concentrazione di farmaco nel flusso sanguigno si chiama Tmax, mentre la concentrazione massima di farmaco rilevata nel flusso sanguigno si chiama Cmax.
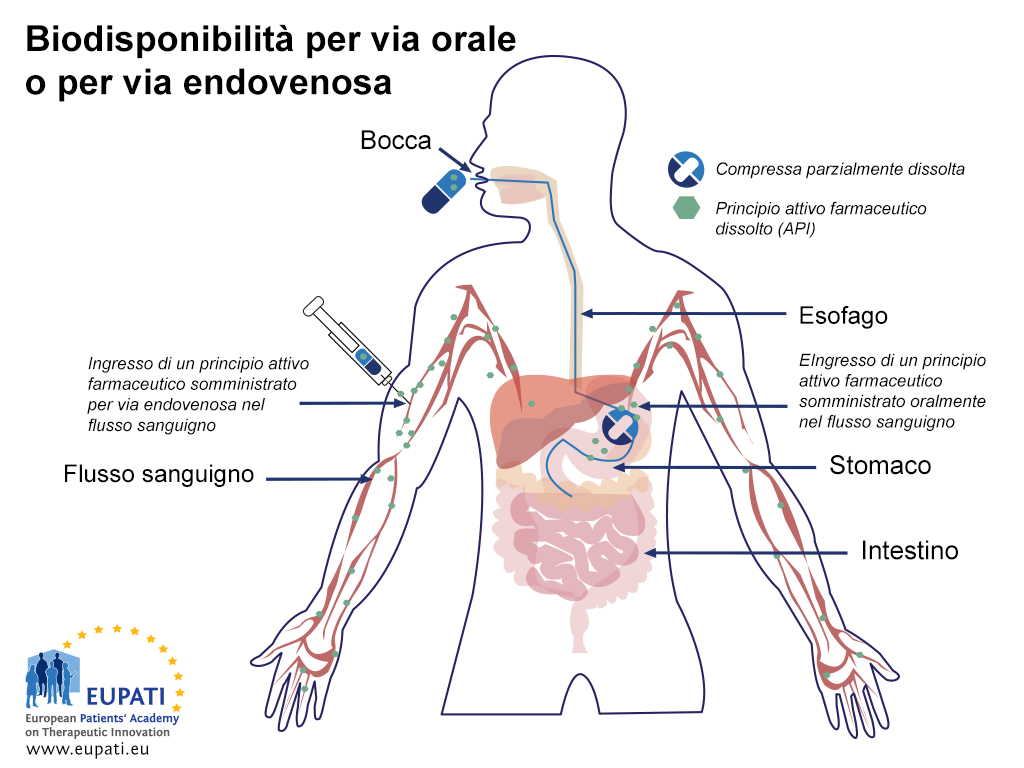
La biodisponibilità più bassa della via orale rispetto all'iniezione endovenosa viene spiegata nella figura sotto (biodisponibilità orale contro endovenosa).
- Immagine schematica che mostra l’assorbimento di una capsula assunta per via orale rispetto all’iniezione di un farmaco praticata direttamente nel flusso sanguigno (iniezione endovenosa). Dopo aver raggiunto lo stomaco, la capsula viene ulteriormente trasportata all’intestino tenue dove viene ulteriormente assorbita.
Dopo che una compressa o una capsula viene deglutita, in uno o due minuti arriva allo stomaco dove si dissolve e parte del principio attivo viene assorbito nel flusso sanguigno. I componenti vengono trasportati all'intestino tenue dove viene completato il loro assorbimento, che può variare considerevolmente. Una biodisponibilità inferiore può essere dovuta a un mancato o scarso assorbimento dello stomaco e dell'intestino, questa è perciò una fase importante che può incidere sulla biodisponibilità.
Quando il principio attivo viene assorbito, raggiunge prima di tutto la vena porta epatica e viene trasportato al fegato. Questa è la prima volta in cui il principio attivo viene metabolizzato nel fegato: si chiama "metabolismo di primo passaggio". Durante questa prima fase del metabolismo, alcuni principi attivi subiscono una metabolizzazione maggiore rispetto ad altri. La parte non metabolizzata del principio attivo, generalmente meno del 100%, raggiungerà la circolazione sistemica attraverso la vena epatica. La quantità che raggiunge effettivamente la circolazione sistemica viene chiamata "biodisponibilità assoluta".
La biodisponibilità assoluta mette a confronto la biodisponibilità di API nella circolazione sistemica a seguito di una somministrazione non endovenosa con la biodisponibilità dello stesso farmaco dopo una somministrazione endovenosa. Rappresenta la percentuale di API assorbito tramite somministrazione non endovenosa rispetto al medesimo farmaco somministrato per via endovenosa.
In breve, per quanto riguarda la biodisponibilità assoluta il riferimento è sempre la somministrazione IV.
La biodisponibilità relativa misura la biodisponibilità di una formulazione (A) di un certo farmaco confrontata con un'altra formulazione (B) del medesimo farmaco, di solito un determinato standard diverso dall'IV oppure tramite una differente via di somministrazione.
La biodisponibilità è influenzata da una serie di altri fattori, i quali sono specifici per ogni singolo individuo. Vedere la nota informativa allegata per alcuni esempi di biodisponibilità.
Bioequivalenza
La bioequivalenza è il rapporto tra due preparazioni, della medesima sostanza e nella stessa forma di dosaggio, che hanno una biodisponibilità simile.
La biodisponibilità relativa non è utilizzata solo per mettere a paragone formulazioni differenti, ma anche quando devono essere confrontate due compresse (o qualsiasi altro farmaco con un'identica formulazione) aventi lo stesso principio attivo prodotto da differenti aziende farmaceutiche. La compressa dell'azienda A viene definito farmaco generico relativo alla compressa di riferimento dell'azienda B (farmaco con marchio). Per vedere se la compressa A è bioequivalente alla compressa B; vengono confrontati i tassi di biodisponibilità dei due farmaci.2
Risorse aggiuntive
- Agenzia per gli alimenti e i medicinali degli Stati Uniti (2002). Orientamento per l'industria: studi di biodisponibilità e bioequivalenza per prodotti medicinali somministrati oralmente – Considerazioni generali. Rockville, MD: Agenzia per gli alimenti e i medicinali degli Stati Uniti. Scaricato il 23 giugno 2015 da http://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM154838.pdf
- Wang, H., Li, Q., Reyes, S., Zhang, J., Xie, L., Melendez, V., Hickman, M. and Kozar, M.P. (2013). Formulation and particle size reduction improve bioavailability of poorly water-soluble compounds with antimalarial activity. Malaria Research and Treatment, Scaricato il 23 giugno 2015 da http://dx.doi.org/10.1155/2013/769234
- Johnson, J.A. (2000). Predictability of the effects of race or ethnicity on pharmacokinetics of drugs. International Journal of Clinical Pharmacology and Therapeutics, 38, 53-60.
Riferimenti bibliografici
- Tatum, R.P., Shi, G., Manka, M.A., Brasseur, J.G., Joehl, R.J. and Kahrilas, P.J. (2000). Bolus transit assessed by an esophageal stress test in postfundoplication dysphagia. Journal of Surgical Research, 91, 56–60.
- MobiSystems, Inc. (2007). Dorland's Medical Dictionary for Health Consumers. [Mobile application software].
Allegati
- Scheda informativa: Esempi di biodisponibilità
Size: 100,516 bytes, Format: .docx
Esempi di biodisponibilità riguardanti la penicillina e l’asma.
A2-1.16-V1.2