Algemene toxiciteitsonderzoeken
Inleiding
Toxiciteitsonderzoeken bestuderen het veiligheidsprofiel van de kandidaatstof. Ze bieden ook belangrijke informatie over absorptie, distributie, metabolisme en excretie (ADME) van de stof in het lichaam. Een kandidaatstof moet in veel verschillende soorten niet-klinische toxiciteitsonderzoeken worden beoordeeld voordat het aan de eerste menselijke vrijwilliger(s) kan worden toegediend. Daarna zijn er nog meer toxiciteitsonderzoeken nodig voordat het geneesmiddel een handelsvergunning krijgt. In het volgende artikel wordt dieper ingegaan op de verschillende typen toxiciteitsonderzoeken die eventueel moeten worden opgenomen in een niet-klinisch programma.
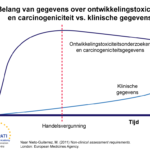
- Er wordt nog altijd meer belang gehecht aan gegevens uit studies naar ontwikkelingstoxiciteit en carcinogeniteit, dan aan klinische gegevens die zijn verzameld tijdens de ontwikkelingsfase en nadat de vergunning voor het in de handel brengen is verleend.
Soorten toxiciteitsonderzoeken
De volgende soorten toxiciteitsonderzoeken moeten worden uitgevoerd gedurende de fase van niet-klinisch testen:
- Systemische toxiciteitsonderzoeken
- Onderzoeken met enkelvoudige doses
- Onderzoeken met herhaalde doses
- Reproductietoxiciteitsonderzoeken (onderzoek naar giftigheid voor de voortplanting)
- Vruchtbaarheidsonderzoeken bij mannen
- Ontwikkelings- en reproductietoxiciteitsonderzoeken bij vrouwen
- Lokale toxiciteitsonderzoeken
- Overgevoeligheidsonderzoeken
- Genotoxiciteitsonderzoeken
- Carcinogeniteitsonderzoeken (onderzoek naar kankerverwekkendheid)
Deze stappen worden één voor één in de onderstaande paragrafen uitgelegd.
Systemische toxiciteitsonderzoeken
Systemische toxiciteitsonderzoeken bestuderen het toxiciteitsprofiel van de kandidaatstof in alle weefsels en organen van het dier. Systemische toxiciteitsonderzoeken kunnen zowel met een enkelvoudige dosis als met herhaalde doses worden uitgevoerd.
Reproductietoxiciteitsonderzoeken
Reproductietoxiciteitsonderzoeken bestuderen het effect van de kandidaatstof op het voortplantingsvermogen en de normale groei ontwikkeling. De uitvoering van deze onderzoeken moet toepasselijk zijn voor de populatie die zal worden blootgesteld aan de kandidaatstof en dient rekening houden met de volgende overwegingen:
- Mannen kunnen worden opgenomen in Fase I en Fase II van klinisch onderzoek vóór de uitvoering van het vruchtbaarheidsonderzoek bij mannen, omdat beoordeling van de mannelijke voortplantingsorganen wordt uitgevoerd in de toxiciteitsonderzoeken met herhaalde dosis. Deze onderzoeken moeten echter wel zo vroeg mogelijk in de procedure plaatsvinden. In elk geval moet een vruchtbaarheidsonderzoek bij mannen zijn afgerond voor de start van grootschalige of langdurige klinische onderzoeken (zoals Fase III-onderzoeken).
- Vrouwen die niet vruchtbaar zijn (bijvoorbeeld permanent gesteriliseerde of postmenopauzale vrouwen) kunnen worden opgenomen in klinische onderzoeken zonder reproductietoxiciteitsonderzoeken, als de relevante toxiciteitsonderzoeken met herhaalde doses (die ook een beoordeling van de vrouwelijke voortplantingsorganen omvatten) zijn uitgevoerd.
- Als vruchtbare vrouwen zijn aangewezen als een mogelijke gebruikerspopulatie van het geneesmiddel, moeten er zo vroeg mogelijk reproductietoxiciteitsonderzoeken worden uitgevoerd.
Lokale verdraagbaarheidsonderzoeken
Lokale verdraagbaarheidsonderzoeken bestuderen het effect van de stof op de huid of ogen. Deze lokale toxiciteitsonderzoeken maken meestal deel uit van de algemene toxiciteitsonderzoeken. Om tegemoet te komen aan een minimale toediening aan mensen via niet-therapeutische weg, bijvoorbeeld een enkelvoudige intraveneuze (in de bloedbaan) dosis om de absolute biologische beschikbaarheid vast te stellen, is een verdraagbaarheidsonderzoek met een enkelvoudige lokale dosis bij één enkele soort meestal voldoende.
Genotoxiciteitsonderzoeken
Genotoxiciteitsonderzoeken bestuderen het effect van de kandidaatstof op de chromosomen en genen, en zijn meestal nodig om de veiligheid bij mensen te bevestigen. Beoordeling van genmutatie wordt als voldoende beschouwd voor alle klinische onderzoeken met enkelvoudige doses. Voor klinische onderzoeken met meerdere doses is een aanvullende beoordeling van de chromosomale schade in zoogdieren nodig, en er moet een volledige reeks genotoxiciteitstesten zijn afgerond voor de start van fase II-klinische onderzoeken. Bij positieve bevindingen in genotoxiciteitstesten moet de noodzaak van meer testen worden overwogen.
Carcinogeniteitsonderzoeken
Carcinogeniteitsonderzoeken beoordelen het effect van de kandidaatstof op kankerontwikkeling. Carcinogeniteitsonderzoeken worden meestal uitgevoerd ter ondersteuning van de aanvraag van een handelsvergunning voor een nieuw geneesmiddel. Als er echter voldoende reden tot zorg is, moeten er carcinogeniteitsonderzoeken worden uitgevoerd om de veiligheid in klinische onderzoeken te bevestigen. In dat geval kan er een langer durend klinisch onderzoek met regelmatige controles worden uitgevoerd. Over het algemeen kunnen voor geneesmiddelen voor ernstige ziekten bij volwassenen of kinderen carcinogeniteitstesten worden afgerond nadat het middel in de handel is gebracht, ervan uitgaande dat vroegtijdige toegang tot geneesmiddelen voor patiënten opweegt tegen het mogelijke risico. Maar hoe eerder de testen kunnen worden voltooid, hoe beter.
Bijlagen
- Presentatie: Niet-Klinische Ontwikkeling
Size: 498,813 bytes, Format: .pptx
Presentatie over de aspecten van niet-klinische ontwikkeling, zoals doelstellingen, achtergrondactiviteiten en de verschillende vormen van niet-klinisch onderzoek.
A2-2.02.4-v1.3