Участие пациентов в регуляторных комитетах EMA
Введение
Эта статья посвящена законодательству Европейского Союза (ЕС) и рекомендациям Европейского агентства по лекарственным средствам (EMA). В ней подробно не рассматривается национальное законодательство или руководства за пределами ЕС. Роль сообществ пациентов описывается на уровне EMA.
Европейское агентство по лекарственным средствам (EMA)
Европейское агентство по лекарственным средствам (EMA) несет ответственность за научную оценку лекарственных препаратов для людей и животных в Европейском Союзе.
EMA участвует в диалоге между пациентами в Европе и потребителей с момента своего основания в 1995 г. Как лица, применяющие лекарственные препараты, которые оценивает EMA, пациенты являются основной заинтересованной стороной в работе EMA, и они могут предложить определенное суждение и экспертное мнение по этому вопросу.
Пациенты и потребители участвуют во многих видах деятельности EMA, от обзора информации по лекарственным препаратам, подготовленной EMA, и участия в подготовке рекомендаций и до участия в научных консультативных группах и членства в научных комитетах EMA.
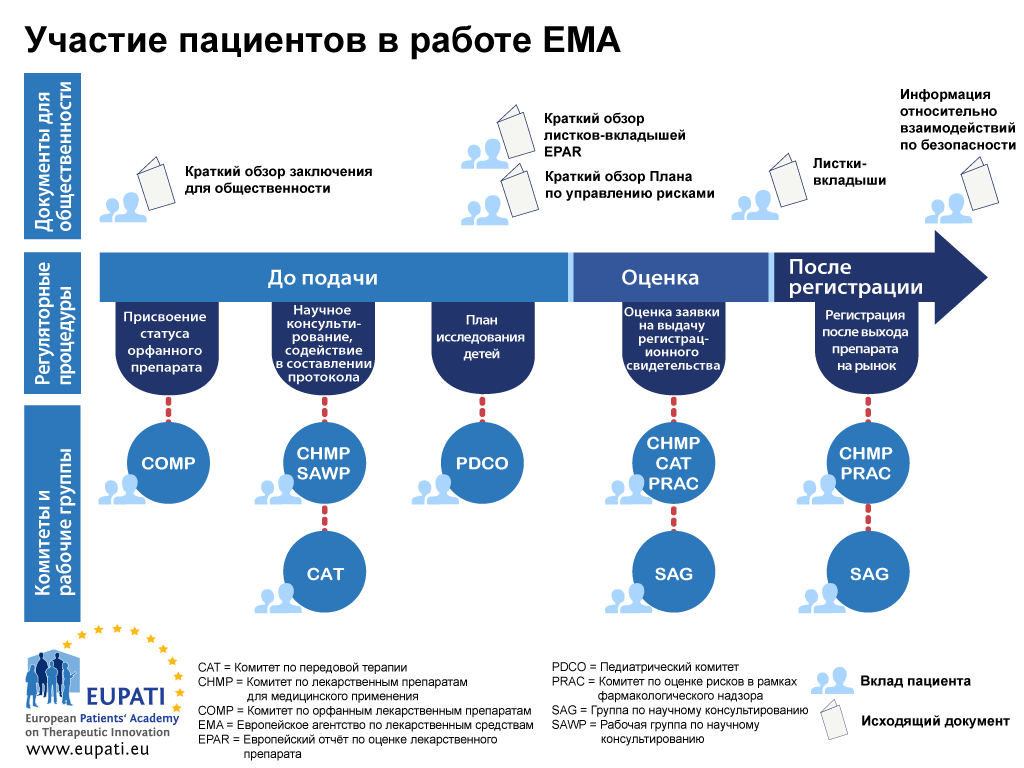
Участие пациентов в регуляторных комитетах EMA
На сегодняшний день внедрение общественного законодательства привело к тому, что пациенты стали членами четырех научных комитетов EMA: Комитета по орфанным лекарственным препаратам (COMP), Педиатрического комитета (PDCO), Комитета по передовой терапии (CAT) и Комитета по оценке рисков в рамках фармакологического надзора (PRAC). Пациенты также представлены в правлении EMA.
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Пациенты могут участвовать в работе EMA по-разному в рамках нормативной процедуры.
Комитет по орфанным лекарственным препаратам (COMP)
В состав COMP входит три члена, которых выдвигают сообщества, представляющих пациентов в Европейской комиссии с момента первого собрания в апреле 2000 г., на срок три года.
Педиатрический комитет (PDCO)
В состав PDCO входит три члена и три заместителя, которые назначаются сообществами, представляющими пациентов в Европейской комиссии с сентября 2008 г., на срок три года.
Комитет по передовой терапии (CAT)
В состав CAT входит два члена и два заместителя, которые назначаются сообществами, представляющими пациентов в Европейской комиссии с января 2009 г., на срок три года.
Комитет по оценке рисков в рамках фармакологического надзора (PRAC)
В состав PRAC входит один член и один его заместитель, которые назначаются сообществами, представляющими пациентов в Европейской комиссии с июля 2012 г., на срок три года.
Роль и значение пациентов как членов научных комитетов
Пациенты, которые являются членами научных комитетов EMA, принимают участие наравне со всеми другими членами. Опыт показывает, что пациенты очень часто участвуют в научных дискуссиях. Дополнительный вклад пациентов и потребителей в работу научных комитетов является уникальным и очень важным, учитывая их реальную жизнь с заболеванием и текущее терапевтическое окружение. Усилия пациента должны быть направлены на то, чтобы донести эту уникальную точку зрения во время деятельности комитета и получения результата его работы.
Все члены комитета:
- Участвуют в соответствии с правилами комитета в отношении процедур и определенных заданий.
- Хранят информацию в конфиденциальности, сообщают обо всех конфликтах интересов и придерживаются правил поведения, установленных EMA.
- Участвуют в принятии решения комитетом с равноправным голосом во время голосования. Заместители могут посещать все собрания комитета и участвовать в его работе и дискуссиях наравне с другими членами.
[glossary_exclude]Дополнительные источники
- Европейское агентство по лекарственным средствам (2014). EMA/652164/2014 Приложение II: деятельность EMA, в которой участвуют пациенты* и потребители. Источник по состоянию на 31 августа 2015 г.: http://www.ema.europa.eu/docs/en_GB/document_library/Other/2014/12/WC500179568.pdf
- Европейское агентство по лекарственным средствам (2014). EMA/24913/2005 ред. 2. Критерии, которым необходимо соответствовать сообществам пациентов и потребителей, участвующих в деятельности Европейского агентства по лекарственным средствам (EMA). Источник по состоянию на 4 сентября 2015 г.: http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf
- Европейское агентство по лекарственным средствам (2013). EMA/272219/2013 Шестой ежегодный отчет по взаимодействию между сообществами пациентов и потребителей (2012). Источник по состоянию на 4 сентября 2015 г.: http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/12/WC500018099.pdf[/glossary_exclude]
Приложения
A2-5.08.1-v1.3