Создание лекарственных препаратов Шаг 5: Доклинические исследования на безопасность
Введение
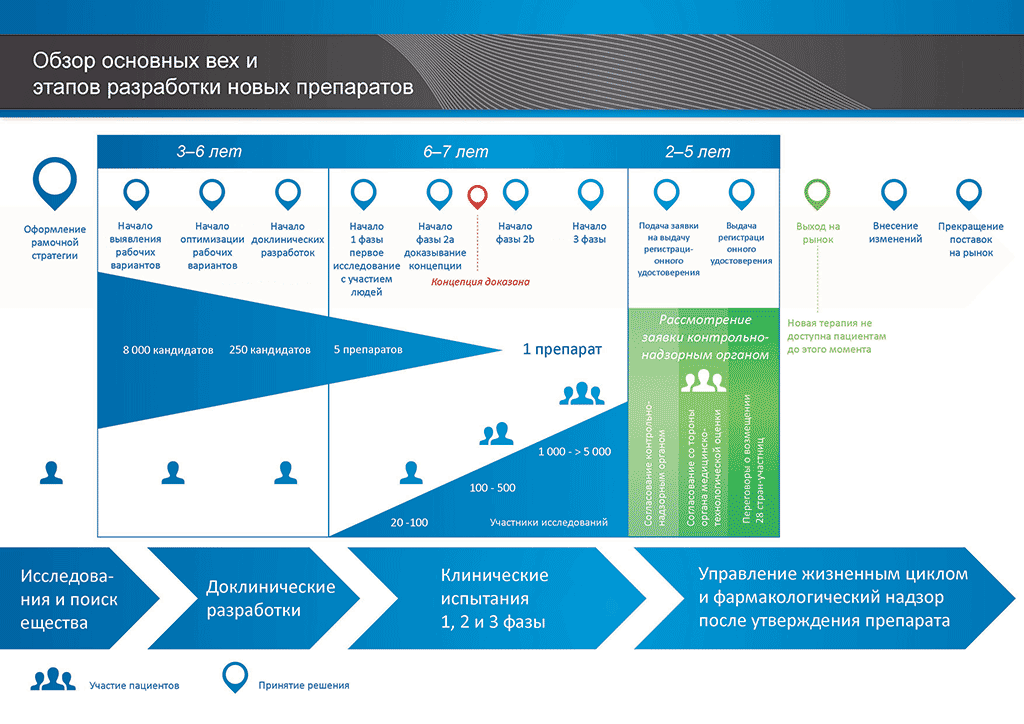
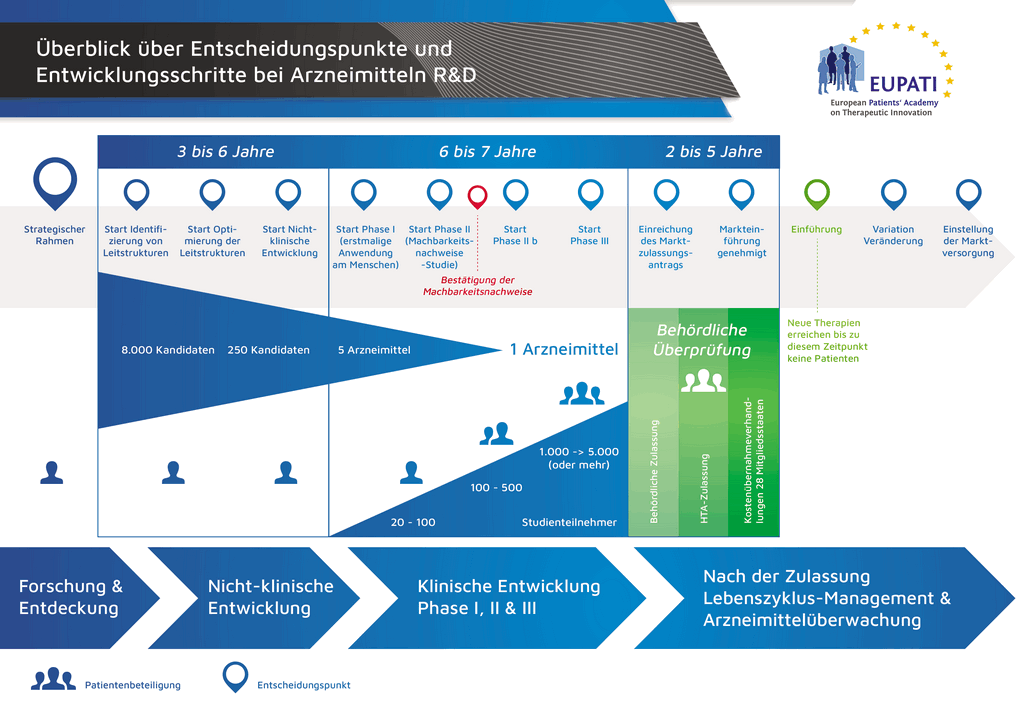
В среднем на все исследования и разработки, необходимые для того, чтобы новый лекарственный препарат был доступен для пациентов, уходит более 12 лет и более 1 миллиарда евро.
Разработка лекарственных препаратов — это рисковый бизнес. Большинство разрабатываемых соединений (около 98 %) так и не выходят на рынок. Так происходит потому, что при оценке преимуществ и рисков (негативных побочных эффектов), обнаруживаемых в ходе разработки, сложно сравнивать их с уже имеющимися на рынке препаратами.
Процесс разработки нового лекарственного препарата можно представить в 10 шагах. Следующая статья описывает 5-й шаг. Доклинические исследования на безопасность.
- С момента создания молекулы до момента начала продажи медицинского препарата проходит больше 10 лет, необходимых для тщательнейшего планирования и исследований.
- Es benötigt mehr als 10 Jahre sorgfältiger Planung und Forschung, bis ein Arzneimittel sich vom Molekül zur marktfähigen Behandlung entwickelt hat.
Шаг 5: Доклинические исследования на безопасность
Безопасно ли вещество для тестирования в рамках клинических испытаний? На данном этапе процесса разработки лекарственного препарата проводятся исследования безопасности на животных, которые регулируются правилами и нормами надлежащей лабораторной практики (GLP). Исследуемое вещество не может быть испытано с участием людей (т.е. в рамках клинических исследований), пока не будут получены данные о его безопасности в рамках исследований безопасности на животных. Процесс разработки препаратов строго контролируется. Законодательство диктует набор правил и норм, которые регулируют, что и как необходимо выполнять.
До того, как можно будет выполнить доклинические исследования, необходимо произвести достаточное количество исследуемого вещества для того, чтобы можно было выполнить все необходимые исследования. Процесс производства также строго регулируется правилами и нормами надлежащей производственной практики (стандартом GMP).
Указанные правила предусматривают, какие исследования необходимо провести и какие виды животных следует использовать для обеспечения достоверных результатов. В этих испытаниях изучается действие:
- на организм животного в целом;
- на тканях и органах животного (системные токсикологические исследования);
- на способность животных к воспроизведению и нормальному развитию (исследования репродуктивной токсичности);
- на кожу или глаза (местные токсикологические исследования);
- на аллергические реакции (исследования гиперчувствительности);
- на хромосомы и гены (исследования генотоксичности);
- на рост раковых клеток (исследования карциногенности).
Эти исследования продемонстрированы на рисунке ниже.
Типы токсикологических исследований
- Систематические токсикологические исследования
- Исследования приема однократной дозы
- Исследования приема многократной дозы
- Исследования репродуктивной токсичности
- Исследования воздействия на оплодотворяющую способность самцов
- Исследования воздействия на репродуктивную систему самок и развитие плода
- Местные токсикологические исследования
- Исследования гиперчувствительности
- Исследования генотоксичности
- Исследования канцерогенности
В этих исследованиях не только устанавливают характеристики безопасности при применении на животных, но еще и узнают важные данные о том, как:
- вещество поступает в организм (всасывание)
- Распределение вещества в организме
- вещество расщепляется организмом (метаболизм)
- вещество выводится из организма (выведение)
На английском языке эти явления иногда обозначаются аббревиатурой «ADME» (absorption, distribution, metabolism, excretion).
Все эти данные используются при принятии решения о том, можно ли применять исследуемое вещество в первом исследовании с участием людей (клиническое исследование), и если да, то в какой дозе.
Для того чтобы можно было начать клинические исследования с участием людей, исследуемое вещество должно демонстрировать допустимые характеристики в плане его безопасности в ходе всех необходимых доклинических токсикологических исследований. Однако не всегда все доклинические исследования к тому времени завершены. Например, долгосрочные исследования канцерогенности в среднем занимают два года и все еще продолжаются, когда уже идут клинические исследования.
Справочная литература
- Edwards, L., Fox, A., & Stonier, P. (Eds.). (2010). Principles and practice of pharmaceutical medicine (3rd ed.). Oxford, UK: Wiley-Blackwell.
Приложения
- Информационный бюллетень Поиск новых препаратов
Size: 1,247,915 bytes, Format: .docx
Поиск новых препаратов. В этом информационном бюллетене описываются этапы поиска новых препаратов и процесс разработки, которые происходят до момента, когда вещество может испытываться на людях — от предварительного этапа (сбора информации о заболевании) до доклинических исследований на безопасность с использованием животных.
A2-1.02.4-v1.1