Основы ранней клинической разработки
Что представляют собой основы ранней клинической разработки?
Ранняя клиническая разработка обычно относится к первым исследованиям лекарственного препарата у людей, которые обычно называются исследованиями 1-й и 2-й фаз.
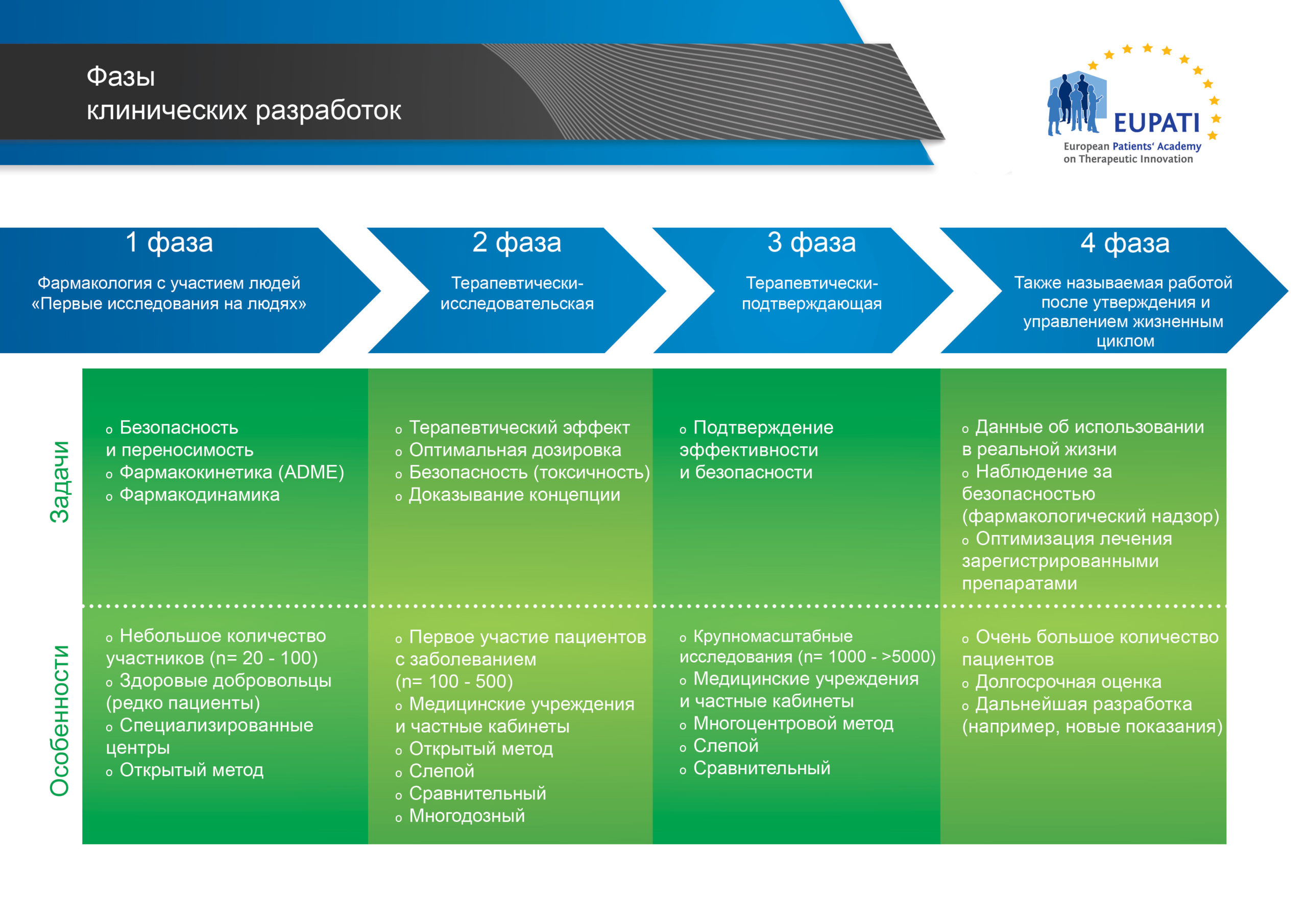
Стадии клинической разработки обычно представлены в виде последовательных фаз, как показано на рисунке ниже:
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- На основании их задач и особенностей выделяют четыре фазы клинических разработок.
Логика представления процесса разработки лекарственных препаратов в ряде последовательных фаз заключается в том, что результаты предыдущих исследований должны влиять на планы последующих исследований: новые данные зачастую будут приводить к изменению стратегии разработки.
Однако исследования классифицируются на фазы не только на основании времени их проведения, а также на основании их целей. В некоторых случаях исследования могут объединять несколько фаз с разными фундаментальными целями.
Это значит, что в процессе разработки лекарственного препарата новые полученные данные могут вызывать необходимость в проведении дополнительных исследований, которые обычно являются исследованиями более ранней фазы. Например, хотя фармакологические исследования с участием людей обычно проводятся во время 1-й фазы, много таких исследований также проводятся во время каждой из последующих фаз (см. диаграмму ниже).
Каковы цели ранней клинической разработки?
Исследования в ранней клинической разработке ориентированы на оценку безопасности и переносимости нового лекарственного препарата. Также в таких исследованиях исследователи пытаются показать потенциал лекарственного препарата оказывать целевое действие.
Во время ранней клинической разработки должны быть получены ответы на приведенные ниже ключевые вопросы:
-
1 фаза
- Является ли лекарственный препарат безопасным для людей? В каких дозах? (переносимость)
- Какое влияние оказывает организм на медицинский препарат? (фармакокинетика (ФК))
- Какое влияние оказывает медицинский препарат на организм? (фармакодинамика (ФД))
- Какие существуют взаимодействия? (межлекарственные взаимодействия, влияние приема пищи и напитков на ФК лекарственного препарата и т. д.)
- Является ли лекарственный препарат активным?
-
Фаза II
- Является ли лекарственный препарат безопасным для пациентов? (безопасность)
- Какое влияние оказывает медицинский препарат на организм? (фармакодинамика (ФД))
- Является ли лекарственный препарат, по всей видимости, действенным у пациентов? В какой/каких дозе/дозах? (действие)
- Как следует планировать проведение подтверждающих исследований? (конечные точки, целевая популяция, другие принимаемые (сопутствующие) лекарственные препараты и т. д.)
Каковы требования для ранней клинической разработки?
Перед началом ранней клинической разработки должно быть получено достаточно данных в доклинических исследованиях, подтверждающих безопасность лекарственного препарата для применения у людей. Далее должен быть составлен план клинической разработки, в котором:
- определяются цели программы клинических исследований;
- устанавливаются требования, которые должны быть выполнены для рассмотрения проверки правильности концепции как положительной;
- описываются дизайн и процесс проведения клинических исследований 1-й и 2-й фаз.
Каким образом принимаются решения во время ранней клинической разработки?
Решения во время разработки препарата ориентированы на данные. Результаты исследований тщательно рассматриваются перед продолжением разработки. Перед возможным продолжением дальнейшей разработки препарата следует проверить правильность концепции и выбрать схему применения препарата. Если в процессе ранней разработки лекарственного препарата получены положительные результаты, то возможно продолжение дальнейших исследований препарата. Неточные результаты, полученные во время ранней клинической разработки, требуют проведения дополнительных исследований и оценки перед принятием решений. Если во время ранней клинической разработки лекарственного препарата получены отрицательные результаты, например, если концепция не в достаточной степени доказана, или появились недопустимые вопросы по безопасности применения препарата, то разработка лекарственного препарата останавливается. Именно на этой стадии разработка большого числа потенциальных лекарственных препаратов должна прекращаться.
A2-5.03.1-V1.1