Новые подходы к проведению клинических испытаний: Адаптивные дизайны
Введение
Согласно традиционной концепции дизайна клинического испытания каждое новое лечение должно пройти процесс разработки с жесткими требованиями. После успешных испытаний фазы I необходимо провести испытание фазы II, чтобы продемонстрировать эффективность и безопасность. После подтверждения эффективности и безопасности лекарственный препарат изучается в испытаниях фазы III, в которых он сравнивается со стандартным лечением (контролем). Если так делать для каждого вида лечения отдельно, это займет много времени и потребует большого количества пациентов и существенных капиталовложений. Кроме того, в рамках этой традиционной концепции не разрешается вносить изменения в ходе испытания.
Одним из новых подходов к проведению клинических испытаний является адаптивный дизайн клинического испытания. Адаптивные клинические испытания предусматривают наличие запланированной заранее возможности изменения одного или более аспектов испытания. Этот подход обычно основывается на анализе промежуточных данных, полученных у участников во время испытания.
Существует много причин для применения адаптивных дизайнов (или адаптивных путей) в рамках клинических испытаний. В сложных экономических условиях адаптивные дизайны, очевидно, представляют интерес для фармацевтической промышленности, академических учреждений, клинических врачей и пациентов.
Адаптивные дизайны
Адаптивные дизайны клинических испытаний — это относительно гибкие дизайны, которые позволяют вносить изменения в ходе испытания, чтобы ускорить и оптимизировать процесс. Анализы собранных в исследовании данных проводятся в запланированные заранее моменты времени в рамках испытания; они могут проводиться в абсолютно слепом режиме или открыто с необязательной формальной проверкой статистической гипотезы. Важно, чтобы процесс был изменен таким образом, чтобы сохранялась достоверность и целостность испытания.
Адаптивные дизайны вследствие своей сложности могут сопровождаться возникновением проблем, связанных с их внедрением, и процесс адаптации испытания может привести к появлению погрешностей. Такие погрешности могут быть статистическими или функциональными — например, если адаптация свидетельствует об определенной направленности результатов испытания.
Адаптивный дизайн может улучшить эффективность испытания для спонсора и участников исследования. Однако если такие исследования проводить неправильно, существует высокий риск получения клинических результатов, которые будет тяжело интерпретировать или внедрить в повседневную практику.
Адаптивные дизайны при редких болезнях
Клинические испытания при редких болезнях в силу обстоятельств обычно бывают небольшими. При планировании небольших клинических испытаний, особенно при редких болезнях, можно столкнуться с некоторыми трудностями. Результаты небольших испытаний более изменчивы, чем результаты более масштабных испытаний, поэтому стандартные дизайны могут привести в тому, что испытания способны будут оценить только значительные эффекты.
Специальные требования к испытаниям при редких болезнях делают адаптивные дизайны для таких испытаний особенно привлекательными. Мощность классических испытаний при редких болезнях обычно связана со значительными эффектами. Мощность статистического критерия — это способность критерия обнаружить эффект, в случае если этот эффект действительно существует. С точки зрения статистики, это вероятность справедливого опровержения нулевой гипотезы.
В некоторых случаях опровергнуть нулевую гипотезу невозможно не потому, что она верна, а потому, что против нее недостаточно доказательств. Это может быть связано с тем, что масштаб эксперимента недостаточен для опровержения нулевой гипотезы. Соответственно, мощность критерия можно описать как вероятность совершить ошибку II рода (не опровергнуть нулевую гипотезу в случае, когда она действительно является ложной).
Адаптивные дизайны являются привлекательной альтернативой, потому что:
- Они сокращают процесс разработки без отрицательного влияния на достоверность или эффективность.
- Можно раньше определить неэффективные способы лечения.
- Они позволяют более эффективно использовать ресурсы.
Однако важно понимать, чего можно достичь, а чего нельзя с помощью адаптивного дизайна в случае изучения редких болезней. Самое главное, адаптивные дизайны не могут сделать лекарственные препараты более эффективными. Они могут, однако, раньше определить неэффективные способы лечения. В случае раннего определения неэффективного лечения можно свести к минимуму объем выделенных средств на исследование неэффективного лечения, что позволит перераспределить ресурсы для изучения более перспективных способов лечения.
Возможные подходы при адаптивном дизайне
Термин «адаптивный» распространяется на многие типы дизайнов, однако большинство из них предусматривает простую структуру исследования. В рамках адаптивного испытания существуют этапы получения данных и подтверждения результатов, в которых используется аналогичный подход к общему процессу клинической разработки в разнообразных условиях испытания (фаза I, фаза II и фаза III). Вследствие этого можно вносить изменения в гипотезы или параметры дизайна.
Этапы получения данных:
- Можно изменять основные элементы дизайна (например, исключать группы лечения).
- Статистические погрешности (например, систематические ошибки, изменчивость данных, неправильный отбор).
- Оценка эффектов лечения (полезных или неблагоприятных).
Этапы подтверждения результатов:
- Очень важно контролировать наличие статистических ошибок и функциональных погрешностей.
- Необходимо проводить жесткий контроль ошибок рода I (например, подтверждение эффективности лечения, если на самом деле оно неэффективно).
Наиболее часто адаптивный дизайн используется в испытаниях, предусматривающих досрочное прекращение вследствие нецелесообразности (когда лечение или испытание не приносит каких-либо полезных результатов) или эффективности.
Условия такого прекращения устанавливаются заранее и подтверждаются результатами одного или более промежуточных анализов. Они предотвращают применение участниками лекарственных препаратов, которые не обладают полезными свойствами или являются небезопасными. Самое главное, если обнаружится, что исследуемый лекарственный препарат более эффективен с клинической точки зрения, чем контрольный препарат, будет неэтично продолжать применение контрольного лекарственного препарата с меньшей эффективностью. Условия досрочного прекращения вследствие нецелесообразности позволяют прекратить применения контрольного лекарственного препарата с меньшей эффективностью.
Существуют также дизайны, в которых группы лечения исключаются в ходе испытания или в которых подгруппы выбираются на основании биомаркеров, представляющих интерес.
Некоторые дизайны позволяют переоценивать объем выборки, например увеличивать выборку пациентов при получении многообещающих результатов.
Адаптивная рандомизация — это еще один наглядный пример привлекательного дизайна. При использовании этого дизайна бо́льшая доля пациентов получают «лучшее» лечение (если таковое существует). Такие адаптивные дизайны преимущественно основаны на открытых промежуточных анализах, в которых оцениваются эффекты лечения — это означает, что лицу, выполняющему анализ, известно, какое именно лечение получают участники.
Примеры адаптивных дизайнов испытаний
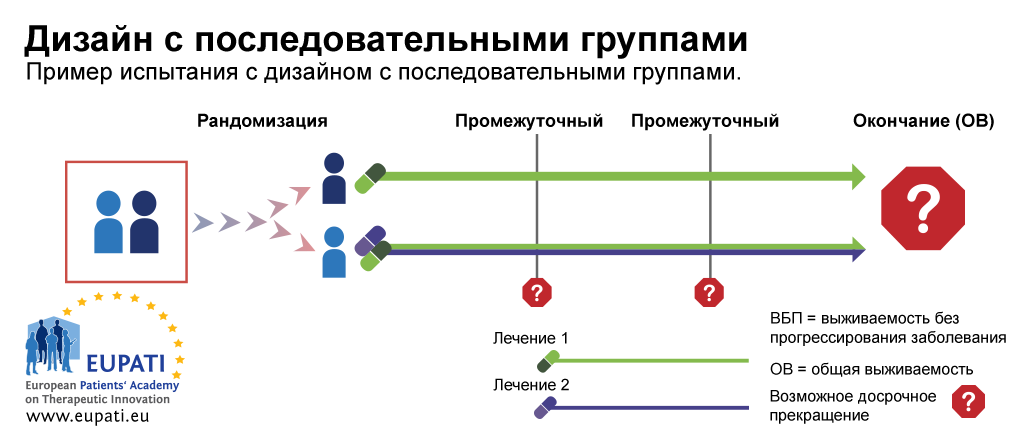
Пример 1: Дизайн с последовательными группами
Дизайн с последовательными группами — это типичный пример испытания фазы III, предусматривающего досрочное прекращение вследствие нецелесообразности или эффективности. На диаграмме ниже изображен пример испытания, в котором пациенты были рандомизированы в группу лечения первой линии с применением одного лекарственного препарата или комбинации двух лекарственных препаратов.
В нем было два промежуточных этапа, во время которых можно было досрочно прекратить испытание и провести анализ до получения всех результатов испытания. Испытание можно было прекратить:
- во время промежуточного этапа 1 вследствие нецелесообразности на основании показателя выживаемости без прогрессирования заболевания (ВБП) – в зависимости от наличия или отсутствия у пациента прогрессирования определенного злокачественного новообразования
- во время промежуточного этапа 2 вследствие нецелесообразности или эффективности на основании показателя общей выживаемости.
Дизайн с последовательными группами является классическим примером, о котором часто забывают в случае рассмотрения адаптивного дизайна, поскольку он уже использовался перед тем, как другие адаптивные дизайны стали более распространенными. Возможность адаптации планируется заранее в дизайне испытания; это приводит к тому, что мощность и ошибки рода I при последовательных анализах можно относительно легко откорректировать в случае проведения нескольких анализов. Это сохраняет общую мощность исследования и определенный уровень ошибок рода I.
- Дизайн с последовательными группами позволяет досрочно прекратить испытание на основании показателей выживаемости без прогрессирования заболевания и общей выживаемости. В данном примере участники были рандомизированы в одну из двух групп и получали лечение 1 или комбинацию лечения 1 и лечения 2.
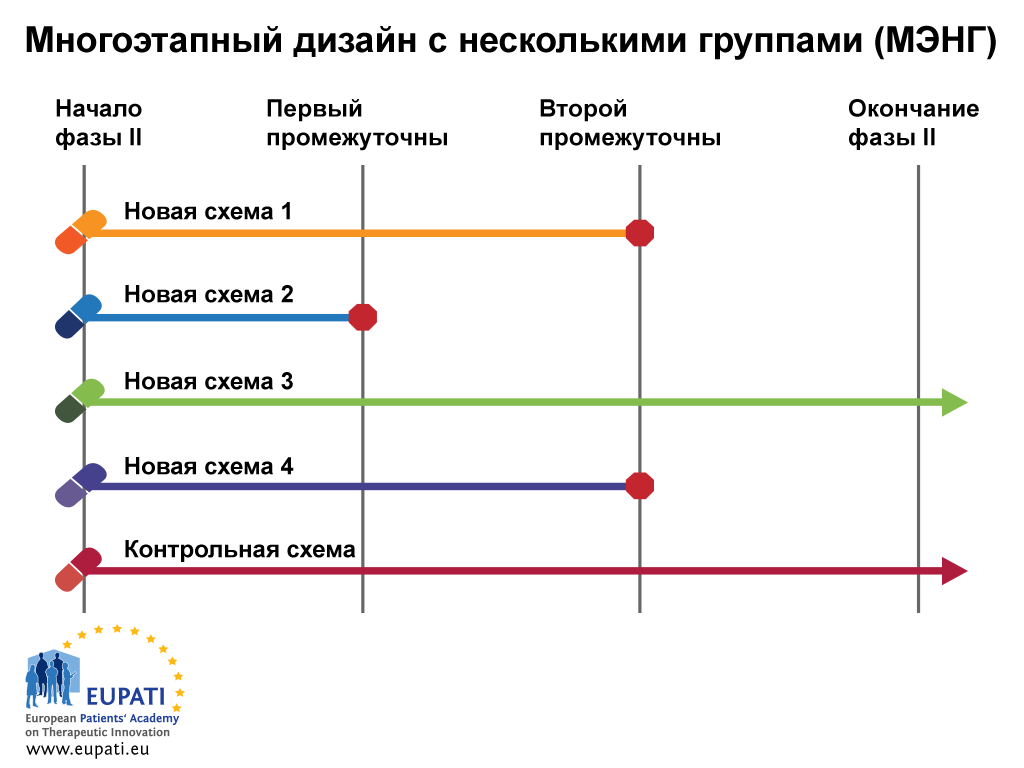
Пример 2. Многоэтапный дизайн с несколькими группами (МЭНГ)
Многоэтапное испытание с несколькими группами (МЭНГ) — это новая концепция проведения рандомизированных, контролируемых испытаний, предусматривающих использование интересного адаптивного дизайна.
Испытания МЭНГ позволяют одновременно оценивать несколько исследуемых видов лечения по сравнению с одной контрольной группой. Испытания МЭНГ позволяют раньше найти ответы на вопросы и потенциально являются более экономически эффективными, чем серия испытаний с традиционным дизайном.
В данном примере показано, что дизайн включает несколько групп и этапов одновременно.
Дизайн МЭНГ требует наличия окончательного и промежуточного основного показателя исхода. Окончательный показатель исхода — это показатель, на котором основываются окончательные выводы; промежуточный показатель исхода является средством скрининга на предмет появления доказательств наличия подтверждающих данных.
В примере ниже на момент проведения первого промежуточного анализа новую схему 2 посчитали недостаточно эффективной по сравнению с контролем, и ее не стали применять на этапе 2. На момент проведения второго промежуточного анализа набор в группы применения новых схем 1 и 4 прекратили, и до конца испытания сохранили только контрольную схему и новую схему 3, которые продолжили применять в испытаниях фазы III.
Преимущества дизайна МЭНГ:
- Меньшее количество пациентов При использовании этого дизайна несколько испытаний проводятся одновременно, что способствует уменьшению количества пациентов, рандомизированных в контрольную группу.
- На испытания лекарственного препарата в целом затрачивается меньше времени. Промежуточные этапы дизайна МЭНГ заменяют отдельный этап фазы II. Решение относительно наличия у лекарственного препарата достаточной активности принимается во время начальной фазы данного испытания.
- Можно подавать меньше заявок и получать меньше разрешений. Работа по законодательному регулированию проводиться для одного, а не для многих испытаний.
- Гибкость. Можно исключать группы, не представляющие интерес, и набирать новые группы.
- Меньшие затраты. Для этого дизайна испытания требуется меньше пациентов, меньше заявок в контрольно-надзорные органы и меньше времени, что в совокупности помогает сократить затраты на разработку.
Недостатки дизайна МЭНГ:
- Функциональные характеристики. Вследствие сложности данного подхода он может тяжело поддаваться регулированию и требовать значительного моделирования во время процесса разработки дизайна.
- Необходимое количество пациентов.
Оно зависит от функциональных характеристик, однако если в ходе испытания добавляются группы лечения, может быть сложно спрогнозировать бюджет и нормативные вопросы.
- Продолжительность испытания
Если добавляются группы лечения, может быть сложно спрогнозировать время прекращения испытания.
- Непрерывное увеличение (набор) контрольной группы. Чтобы избежать погрешностей, связанных со сдвигом во времени, в случае добавления новых групп лечения необходимо продолжать набор в контрольную группу в течение всего испытания. Необходимо учитывать возможность появления нового стандартного лечения во время проведения испытания — будет ли тогда все еще уместен данный контрольный препарат?
- Сравнение между экспериментальными группами. Дизайн МЭНГ только позволяет сравнивать отдельные группы лечения с контрольной группой; он не позволяет сравнивать отдельные группы лечения между собой.
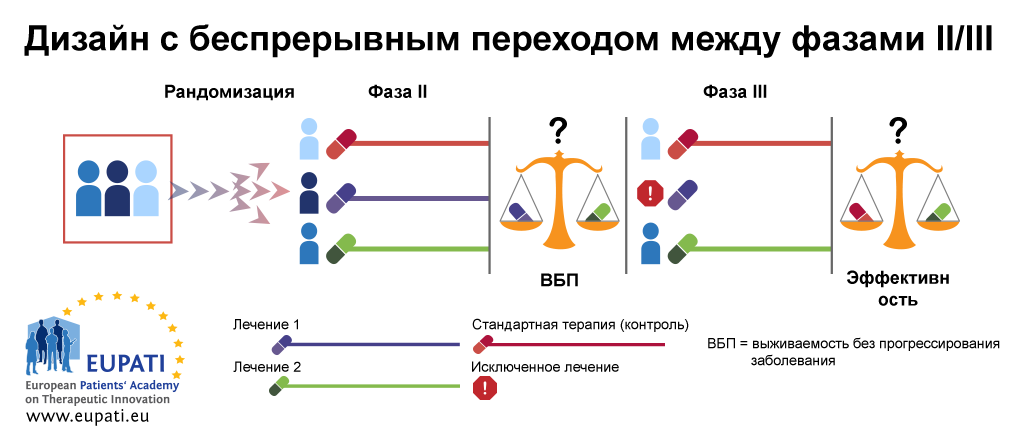
Пример 3: Дизайн с беспрерывным переходом между фазами II/III
Дизайн с беспрерывным переходом между фазами II/III часто используется при редких болезнях; его также называют «комбинированный анализ». В примере ниже на первом этапе данного дизайна пациентов рандомизировали в три группы лечения (фазы IIb). Первая группа лечения является контрольной группой, в которой участники получают стандартную терапию. Пациенты второй и третьей группы лечения получают разные виды лечения: лечение 1 или лечение 2.
В конце первого этапа (фаза IIb) лечение 1 и лечение 2 сравниваются на основании наилучшего показателя выживаемости без прогрессирования заболевания (ВБП). Группа применения наименее эффективного лечения исключается. После этого оставшаяся группа лечения переходит на второй этап (фаза III). На этом этапе эффективность данного лечения сравнивается с эффективностью стандартного лечения.
- Дизайн с беспрерывным переходом между фазами II/III позволяет проводить фазы II и фазы III в рамках одного испытания.
Преимущества дизайна с беспрерывным переходом между фазами II/III
- Помогает уменьшить количество погрешностей. Оба этапа проводятся независимо друг от друга, а в конце их результаты объединяются с получением общего результата анализа.
- Сокращает время и воздействие на пациентов.
Фаза II и фаза III проводятся в рамках одного испытания.
- Относительной гибкий. Относительно гибкий способ выбора группы лечения для проведения заключительного сравнения в фазе II и ее перехода в фазу III.
- Эффективное применения ресурсов.
В заключительных анализах используются данные пациентов, полученные во время обеих фазы — II и III.
Недостатки
- Сложные статистические анализы.
Этот дизайн требует использования статистических подходов, которые являются довольно непростыми.
- Перерывы в наборе пациентов. Между двумя фазами прерывается набор пациентов, когда ожидается получение достаточного количества данных, чтобы провести промежуточный анализ и решить, стоит ли продолжать испытание.
- Логистические трудности Этот дизайн связан с логистическими трудностями — он требует быстрого потока данных, чтобы можно было проконтролировать количество явлений при проведении анализа.
- Трудности, возникающие вследствие долгосрочных конечных точек. Этот дизайн требует относительно быстрого получения информации по ВБП. Наличие долгосрочных конечных точек усложняет данный процесс.
- Риск потери информации. При объединении двух групп возникает риск потери информации.
Участие пациентов
Участие пациентов в выборе адаптивного дизайна может помочь исследователям определить наиболее подходящий дизайн за счет содействия в определении и понимании нужд и требований данной категории пациентов. Пациенты также могут участвовать в работе Комитета по мониторингу данных.
Выводы:
Современные дизайны исследований дают возможность:
- использовать гибкие стратегии;
- эффективнее использовать ресурсы;
- сократить процесс разработки препарата.
Что касается нормативных аспектов, важно сохранить достоверность и целостность адаптивных дизайнов в клинических исследованиях:
- Касаются таких же вопросов, как и в случае классических дизайнов исследований.
- Контролируются функциональные погрешности.
- Контролируются возможные ошибки, связанные со статистической достоверностью.
- Интерпретация результатов.
Приложения
- Презентация: Принципы современных дизайнов испытаний
Size: 840,004 bytes, Format: .pptx
В данной презентации рассматривается традиционная концепция клинической разработки и обсуждаются альтернативные варианты, в частности адаптивный дизайн клинических испытаний.
A2-4.08-v1.2