Доказательная медицина
Введение
У Лизы сильные боли после операции. Врачу необходимо сделать выбор в пользу таблеток, исходя из внешних клинических подтверждающих данных, или инъекции, исходя из личного клинического опыта и предпочтений пациентки. Врачу известно, что, согласно внешним клиническим подтверждающим данным, таблетки, содержащие морфий, были бы лучшим выбором. Однако, как выяснилось при операции, Лиза страдает от распространенного побочного эффекта анестезии — рвоты. Это означает что, если Лиза примет таблетку и у нее начнется рвота, содержимое таблетки выйдет наружу и не окажет обезболивающего эффекта. Врачу и Лизе известно по предыдущему опыту, что рвота у Лизы может начаться в течение 30 минут после окончания действия анестезии. Поэтому вместо таблетки врач решает назначить Лизе инъекцию с морфием.
В приведенном примере врач, основываясь на личном клиническом опыте и предпочтениях пациентки, принимает решение использовать инъекцию с морфием вместо таблетки с морфием, хотя именно в пользу последней говорят лучшие внешние клинические данные. Врач использует одно и то же медицинское вещество (т.е. морфий), как и предполагают внешние клинические данные, однако выбирает другую лекарственную форму (инъекцию вместо таблетки).
Это пример принятия врачом определенного решения в процессе лечения, основанного на подтверждающих данных, после обсуждения с пациентом.
Что такое доказательная медицина?
Доказательная медицина (evidence-based medicine, EBM) — это процесс систематического пересмотра, оценки и использования результатов клинических исследований с целью оказания оптимальной медицинской помощи пациентам. Информированность пациентов о доказательной медицине имеет большое значение, поскольку позволяет им принимать более осознанные решения об управлении и лечении заболевания. Она также позволяет пациентам сформировать более точное представление о риске, способствует целесообразному использованию отдельных процедур и позволяет врачу и (или) пациенту принимать решения, исходя из подтверждающих данных.
Доказательная медицина сочетает в себе принципы и методы. Благодаря действию этих принципов и методов решения, инструкции и стратегии в медицине основываются на текущих подтверждающих данных об эффективности разных форм течения и медицинских услуг в целом. В отношении лекарственных средств доказательная медицина во многом опирается на информацию, полученную в ходе оценки преимуществ и рисков (результативности и безопасности).
Понятие доказательной медицины появилось в 1950-х гг. До этого момента врачи принимали решения в основном на основе своего образования, клинического опыта и чтения научных периодических изданий. Однако исследования показали, что решения о медицинском лечении у разных медицинских специалистов значительно различались. Была формирована база для внедрения систематических методов сбора, оценки и организации данных научных исследований, что и стало началом доказательной медицины. Появление доказательной медицины было признано врачами, фармацевтическими компаниями, контрольно-надзорными органами и общественностью.
Тому, кто принимает решение, необходимо опираться на собственный опыт лечения пациентов в сочетании с лучшими подтверждающими данными, полученными в ходе контролируемых исследований и научных разработок. Важно в процессе принятия решений сочетать клинический опыт и контролируемые исследования. При отсутствии клинического опыта риск, связанный с определенным лечение, может закончиться появлением нежелательных эффектов.
Пятиэтапная модель доказательной медицины
Один из подходов к доказательной медицине предполагает модель из 5 этапов:
- формирование клинически релевантного запроса (поиск врачом информации для постановки правильного диагноза),
- поиск лучших подтверждающих данных (поиск врачом подтверждающих данных в поддержку информации, обнаруженной на этапе 1),
- оценка качества подтверждающих данных (обеспечение врачом высокого качества и надежности),
- формирование медицинского решения на основе подтверждающих данных (принятие пациентом и врачом осознанного решения о лечении на основе этапов 1-3),
- оценка процесса (оценка врачом и пациентом достигнутого результата и соответствующая корректировка решений о лечении в случае необходимости).
В вышеприведенном примере выбор врача согласуется как с принципами доказательной медицины, так и с обратной связью от пациента. Решение, принятое врачом, подразумевает сознательное, открытое и осознанное использование лучших подтверждающих данных на текущий момент времени, в том числе опыт пациентки, для выбора наилучшего из возможных способов медицинской помощи данной пациентке.
Участие пациентов в процессе принятия решений имеет важное значение для выработки новых принципов лечения. Такое участие подразумевает чтение и понимание информации о лечении и осознанное следование рекомендациям, совместную работу с клиническими специалистами, направленную на оценку и выбор лучших вариантов лечения, а также предоставление обратной связи относительно полученных результатов. Пациенты могут активно участвовать в создании подтверждающих данных на любом уровне.
Оценка подтверждающих данных для нужд доказательной медицины
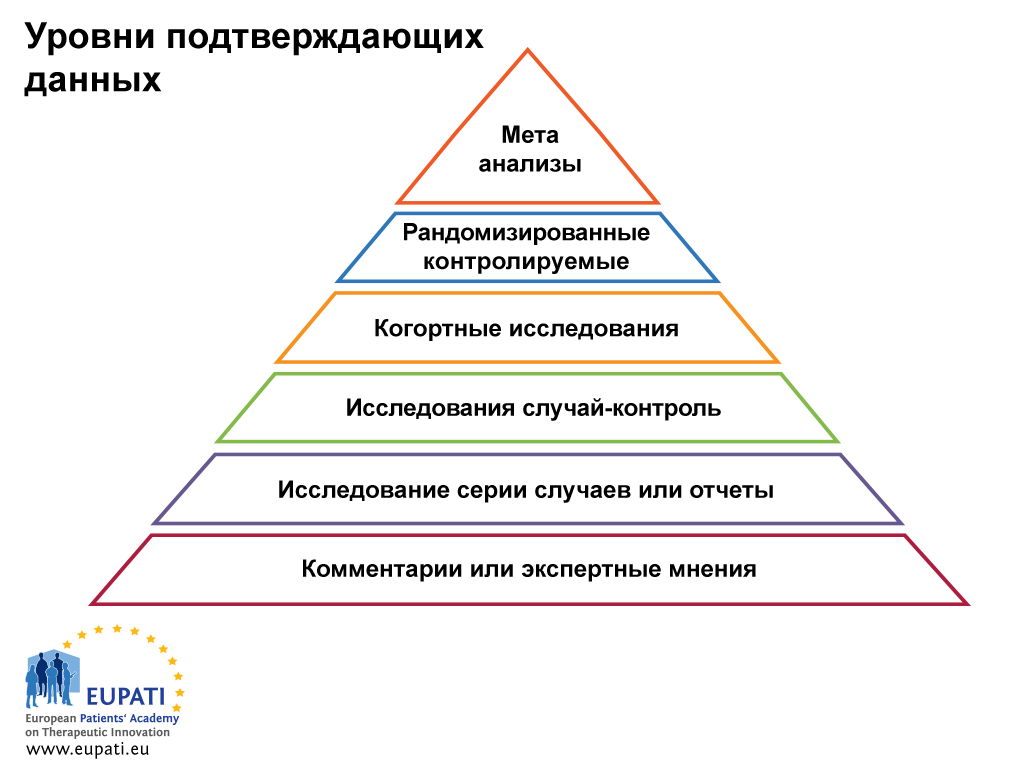
Собранная информация классифицируется в зависимости от уровня содержащихся в ней подтверждающих данных с целью оценки их качества. Пирамида на нижеуказанном рисунке демонстрирует разные уровни подтверждающих данных и их ранжирование.
- Классификация подтверждающих данных по уровням удобна для оценки их качества.
Комментарии или экспертные мнения
Это подтверждающие данные, основанные на мнениях панели экспертов и направленные на формирование общей медицинской практики.
Исследование серии случаев и описания клинических случаев
Исследование серии случаев — это описательное исследование небольшой группы людей. Как правило, оно служит дополнением или приложением к описанию клинического случая. Описание клинического случая представляет собой подробный отчет о симптомах, признаках, диагнозе, лечении и сопровождении одного пациента.
Исследования случай-контроль
Исследование случай-контроль — это наблюдательное ретроспективное исследование (с обзором исторических данных), в котором пациенты, страдающие каким-либо заболеванием, сравниваются с пациентами, не имеющими этого заболевания. Такие случаи, как заболевание раком легких, как правило, изучаются методом исследования случай-контроль. Для этого набирается группа курящих лиц (группа под воздействием) и группа некурящих лиц (группа не под воздействием), за которыми устанавливается наблюдение на протяжении определенного периода времени. Затем разница в частотности заболевания раком легких фиксируется документально, что позволяет рассмотреть переменную (независимую переменную — в данном случае, курение) как причину зависимой переменной (в данном случае, рака легких).
В этом примере статистически значимое увеличение случаев заболевания раком легких в группе курящих по сравнению с некурящей группой рассматривается как подтверждение причинной связи между курением и возникновением рака легких.
Когортное исследование
Современное определение когорты в клиническом исследовании — группа лиц, обладающих определенными характеристиками, за которыми ведется наблюдение с целью выявления последствий, связанных со здоровьем.
Фрамингемское исследование сердечных заболеваний — это пример когортного исследования, проводимого с целью найти ответ на вопрос в области эпидемиологии. Фрамингемское исследование начато в 1948 году и продолжается до сих пор. Цель исследования — изучить воздействие ряда факторов на частоту возникновения сердечных заболеваний. Вопрос, который стоит перед исследователями — связаны ли такие факторы как высокое артериальное давление, избыточная масса тела, диабет, физическая активность и другие факторы с развитием сердечных заболеваний. Для исследования каждого из факторов воздействия (например, курения) исследователями набирается группа курящих людей (группа под воздействием) и группа некурящих людей (группа не под воздействием). Затем за группами ведется наблюдение на протяжении определённого периода времени. Затем в конце периода наблюдения документально фиксируется разница в частоте возникновения сердечных заболеваний в этих группах. Группы сопоставляются с точки зрения многих других переменных факторов, таких как
- экономический статус (например, образование, доход и род занятий),
- состояние здоровья (например, наличие других заболеваний).
Это означает, что переменная (независимая переменная — в данном случае, курение) может изолироваться в качестве причины зависимой переменной (в данном случае, рака легких).
В этом примере статистически значимое увеличение случаев сердечных заболеваний в группе курящих по сравнению с некурящей группой рассматривается как подтверждение причинной связи между курением и возникновением сердечных заболеваний. Результаты, обнаруженные в ходе Фрамингемского исследования на протяжении многих лет, убедительно доказывают, что сердечно-сосудистые заболевания в значительной мере являются результатом измеримых и поддающихся коррекции факторов риска, и что человек может контролировать состояние здоровья своей сердечной системы, если внимательно следит за своим питанием и образом жизни и отказывается от потребления рафинированных жиров, холестерина и курения, снижает вес или начинает вести подвижный образ жизни, регулирует уровень стресса и артериального давления. В основном именно благодаря Фрамингемскому исследованию мы сейчас имеем ясное представление о связи определенных факторов риска с сердечными заболеваниями.
Еще одним примером когортного исследования, которое проводится уже много лет, является «Национальное исследование развития ребенка» (National Child Development Study, NCDS) — самое изучаемое из всех британских когортных исследований новорожденных. Самое крупное исследование, касающееся женщин — это «Исследование здоровья медицинских сестер» (Nurses Health Study). Оно началось в 1976 году, количество сопровождаемых лиц — более 120 тысяч человек. По данным этого исследования анализировались многие заболевания и результаты.
Рандомизированные клинические испытания
Клинические испытания называют рандомизированными, если при распределении участников в разные группы лечения используют метод рандомизации. Это означает, что группы для лечения наполняются случайным образом с использованием формальной системы, и для каждого участника существует вероятность попасть в каждое из исследуемых направлений.
Мета-анализ
Мета-анализ — это систематическое, основанное на статистике рассмотрение данных, в котором сопоставляются и комбинируются результаты разных исследований, направленное на выявление шаблонов, несоответствий и других связей во множестве исследований. Мета-анализ может служить подтверждением для более убедительного вывода по сравнению с любым отдельным исследованием, но необходимо помнить о недостатках, связанных с систематическими ошибками из-за предпочтительных публикаций положительных результатов исследования.
Исследование результатов
Исследование результатов — это широкое зонтичное понятие, не имеющее постоянного определения. В исследовании результатов изучаются конечные результаты медицинской помощи, иначе говоря, эффект от процесса оказания медицинских услуг на здоровье и самочувствие пациентов. Другими словами, исследования клинических результатов направлены на мониторинг, понимание и оптимизацию воздействия медицинского лечения на конкретного пациента или определенную группу. В таких исследованиях описываются научные изыскания, которые связаны с эффективностью мер здравоохранения и медицинских услуг, то есть результаты, полученные благодаря таким услугам.
Часто внимание концентрируется на лицо, страдающее заболеванием — иначе говоря, на клинические конечные точки (общие результаты), наиболее релевантные для этого пациента или группы пациентов. Такими конечными точками могут быть качество жизни или степень болевых ощущений. Однако исследования результатов могут также быть сфокусированы на эффективности предоставления медицинских услуг, при этом параметрами измерения могут быть эффективность затрат, состояние здоровья и тяжесть заболевания (влияние проблем со здоровьем на человека).
Разница между доказательной медициной и исследованиями результатов состоит в концентрации внимания на разных вопросах. В то время как основной задачей доказательной медицины является обеспечение пациенту оптимальной медицинской помощи в соответствии с клиническими подтверждающими данными и опытом, исследования результатов направлены прежде всего на предопределение конечных точек. В исследовании клинических результатов эти точки обычно соответствуют клинически релевантным конечным точкам.
| Вид конечной точки | Пример |
|---|---|
| Физиологический параметр (биомаркер) | Артериальное давление |
| Клиническая | Сердечная недостаточность |
| Симптомы | Кашель |
| Функциональные способности и потребность в уходе | Параметр измерения функциональных способностей, например, способности выполнять ежедневные бытовые действия, оценки качества жизни |
В исследованиях результатов релевантными конечными точками часто становятся симптомы или параметры измерения функциональных способностей и потребности в уходе — то, что пациент, получающий лечение, считает важным. Например, пациент, страдающий от инфекции, которому введен пенициллин, может обращать большее внимание на то, что у него нет высокой температуры и улучшилось общее состояние, чем на воздействие пенициллина на фактический уровень инфекции. В этом случае симптомы и то, как он себя чувствует, рассматривается как прямая оценка состояния его здоровья — а это те конечные точки, на которых концентрируется внимание при проведении исследования результатов. Пациент также, вероятнее всего, будет заинтересован в возможных побочных эффектах, связанных с пенициллином, а также в стоимости лечения. В случае с другими заболеваниями, такими как рак, важным клиническим результатом, релевантным для пациента, будет риск смертельного исхода.
В случае если исследование является продолжительным по времени, при изучении результатов исследований могут использоваться «суррогатные конечные точки». Суррогатная конечная точка предполагает использование биомаркера для измерения результата, действуя в качестве замены для клинической конечной точки, измеряющей эффективность. Рассмотрим клиническое исследование, в котором эффект от пенициллина проверяется по снижению количества одного из видов белка (С-реактивного белка), который всегда присутствует в крови. Количество этого белка в крови здорового человека очень мало, но при острой инфекции оно стремительно повышается. Таким образом, измерение уровня С-реактивного белка в крови — косвенный способ определения наличия инфекции в организме, поэтому в данном случае белок служит «биомаркером» инфекции. Биомаркер — это измеримый показатель состояния болезни. Этот параметр также коррелируется с риском возникновения или прогрессирования заболевания или с тем, как предписанное лечение повлияет на заболевание. Ежедневно у пациента производится забор крови на анализ для измерения количества биомаркера в крови.
Необходимо подчеркнуть, что для использования суррогатной конечной точки с целью контроля и надзора, маркер нужно заранее подтвердить или проверить. Необходимо продемонстрировать, что изменения с биомаркером коррелируются (согласовываются) с клиническим результатом в случае с конкретным заболеванием и эффектом от лечения.
Дополнительные источники
- World Health Organisation (2008). Where are the patients in decision-making about their own care? Retrieved 31 August, 2015, from http://www.who.int/management/general/decisionmaking/WhereArePatientsinDecisionMaking.pdf
A2-1.10-v1.3