Last update: 11 Ιουλίου 2023
Εισαγωγή
Συνεργασία της ομάδας ασθενών-καταναλωτών {1} με τη φαρμακευτική εταιρεία Eli Lilly.
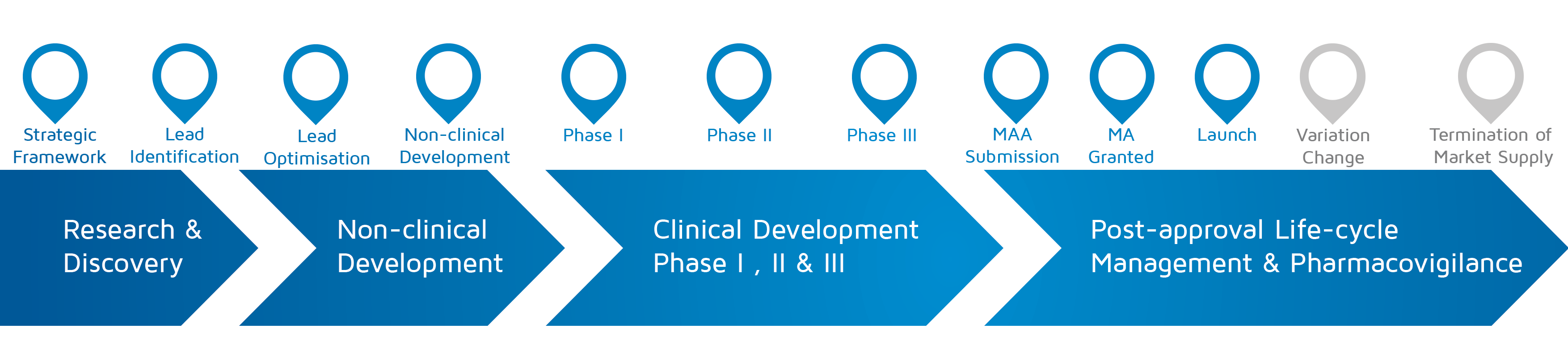
Πότε λαμβάνει χώρα; – Στρατηγικό πλαίσιο για την έναρξη
Περιγραφή της υπόθεσης
Στο Ηνωμένο Βασίλειο, το Εθνικό Ινστιτούτο Έρευνας για την Υγεία (National Institute for Health Research, NIHR) ιδρύθηκε τον Απρίλιο του 2006 για να καθορίσει το πλαίσιο μέσω του οποίου το Υπουργείο Υγείας θα μπορούσε να θέσει, να διατηρήσει και να διαχειριστεί την έρευνα, το ερευνητικό προσωπικό και την ερευνητική υποδομή του εθνικού συστήματος υγείας (NHS) στην Αγγλία ως εθνικές ερευνητικές εγκαταστάσεις. Αποστολή του NIHR είναι η διατήρηση ενός συστήματος έρευνας στον τομέα της υγείας, μέσω του οποίου το NHS θα υποστηρίζει εξέχοντα άτομα που εργάζονται σε εγκαταστάσεις διεθνούς κύρους, διεξάγοντας πρωτοπόρα έρευνα με επίκεντρο τις ανάγκες των ασθενών και του κοινού.
Η Lilly UK Clinical Operations ζήτησε ανατροφοδότηση (feedback) σχετικά με το φυλλάδιο οδηγιών χρήσης για γονείς από μια ομάδα εκπροσώπησης των καταναλωτών αναφορικά με μια κλινική μελέτη που αφορούσε παιδιά ηλικίας 7 έως 14 ετών, μέσω του ερευνητικού δικτύου Medicines for Children Research Network (μέρος του NIHR).
Οι παρατηρήσεις της ομάδας καταναλωτών είχαν ως αποτέλεσμα τη σημαντική αναθεώρηση του εγγράφου και, κατά συνέπεια, την αναθεώρηση των εντύπων συγκατάθεσης για παιδιά και εφήβους. Αν και η σύνδεση με τα Δίκτυα Κλινικής Έρευνας NIHR αποτελεί πια κοινή πρακτική για τον σχεδιασμό, την οργάνωση και τη διαδικασία εγγραφής κλινικών δοκιμών, η συμμετοχή των ομάδων υποστήριξης καταναλωτών και ασθενών βρίσκεται σε αρχικό στάδιο.
Τύποι συμμετεχόντων ασθενών (ή συνηγόρων ασθενών)
- Γονείς του ασθενούς με προσωπική εμπειρία από την ασθένεια. Γονείς με εμπειρία στην αναθεώρηση των φυλλαδίων οδηγιών χρήσης (ΦΟΧ).
Οφέλη από τη συμμετοχή των ασθενών
Οι παρατηρήσεις από την ομάδα καταναλωτών σχετικά με το πώς θα ήθελαν να είναι ένα ΦΟΧ ήταν πολύ χρήσιμη για τη Lilly στο πλαίσιο του μετασχηματισμού μας σε έναν ασθενοκεντρικό οργανισμό. Η συνεργασία αυτή είχε ως αποτέλεσμα η Lilly και ο CRO (επί συμβάσει ερευνητικός οργανισμός) – εταίρος να αναδημιουργήσουν τα έγγραφα με διατύπωση πολύ πιο φιλική προς τον ασθενή, αποφεύγοντας την επιχειρηματική, τεχνική και ιατρική ορολογία (π.χ. χορηγός, προμηθευτής και υποκείμενο) που θα ήταν δύσκολο να κατανοήσει κάποιος εκτός του πεδίου της κλινικής έρευνας.
Εκτός από την αξιολόγηση από την πλευρά των ασθενών, το όφελος για τη Lilly ήταν επίσης το συντομότερο χρονοδιάγραμμα αναθεώρησης από το Συμβούλιο Δεοντολογικού Ελέγχου (ERB) (μόλις 20 ημέρες από τη συνεδρίαση του ERB έως την έκδοση της έγκρισης) και τα πολύ λίγα σχόλια που ελήφθησαν σχετικά με τα έγγραφα.
Τα ERB ενδιαφέρονται όλο και περισσότερο για τον τρόπο με τον οποίο οι ασθενείς συμμετέχουν στην ερευνητική διαδικασία. Στο έντυπο αίτησης ERB περιλαμβάνεται ένα σχετικό ερώτημα με σκοπό την καταγραφή της πληροφορίας αυτής, και, παρόλο που η συμμετοχή των ασθενών δεν αποτελεί επί του παρόντος προϋπόθεση, είναι επιθυμητή για τα ERB.
Προκλήσεις και εμπόδια
Οι αλλαγές στα φυλλάδια οδηγιών χρήσης/έντυπα συγκατάθεσης κατόπιν ενημέρωσης (ΕΣΕ) δεν είναι εύκολη υπόθεση, δεδομένου ότι εφαρμόζεται μια διαδικασία σύνταξης ΕΣΕ με υποχρεωτικά πρότυπα και διατύπωση. Για να υλοποιηθούν οι προτάσεις της ομάδας καταναλωτών, χρειάστηκε η προσαρμογή/τροποποίηση τμημάτων των σύνθετων εγγράφων και του τοπικού προτύπου ΕΣΕ και η έγκριση αλλαγών εσωτερικά, γεγονός που απαιτούσε επιπλέον χρόνο και σημαντικές συζητήσεις με όλους τους εμπλεκόμενους φορείς.
Ο αναθεωρητής της ομάδας καταναλωτών είχε στη διάθεσή του ένα πολύ σύντομο χρονικό διάστημα διεκπεραίωσης, διάρκειας δύο εβδομάδων, και, επομένως, για ολόκληρη τη διαδικασία που περιλάμβανε τη λήψη ανατροφοδότησης, την ενσωμάτωση των προτάσεων στα έγγραφά μας, τη συζήτηση σε εσωτερικό επίπεδο και την έγκριση των αλλαγών κ.λπ. χρειάστηκε επιπλέον χρόνος, με αποτέλεσμα να καθυστερήσει η υποβολή του ERB κατά περίπου ένα μήνα σε σχέση με την αρχική προγραμματισμένη ημερομηνία.
Διδάγματα
Κατανοήστε εκ των προτέρων πώς λειτουργεί η διαδικασία αναθεώρησης για την εν λόγω ομάδα υποστήριξης καταναλωτών/ασθενών. Ποιος είναι ο αναμενόμενος χρόνος διεκπεραίωσης και αν συναντώνται σύμφωνα με ένα σταθερό χρονοδιάγραμμα (π.χ. συναντήσεις ad hoc ή σε μηνιαία βάση);
Εκ των προτέρων σχεδιασμός στο αρχικό στάδιο της διαδικασίας οργάνωσης, ώστε να υπάρχει επαρκής χρόνος για το στάδιο της υποστήριξης καταναλωτών και να αποφευχθεί οποιαδήποτε καθυστέρηση στο χρονοδιάγραμμα υποβολής ERB. Έγκαιρη κοινοποίηση του σχεδίου στα μέλη της ομάδας μελέτης της Lilly, τα οποία θα κληθούν να διατυπώσουν τις προτάσεις τους προκειμένου να υποστηρίξουν την ανάπτυξη του ΕΣΕ.
Το ιδανικό θα ήταν η δημιουργία μιας τυποποιημένης διαδικασίας για τη συμμετοχή των ομάδων εκπροσώπησης καταναλωτών/ομάδων υποστήριξης ασθενών για την πλειονότητα των κλινικών μελετών της Lilly στο Ηνωμένο Βασίλειο και η διεξαγωγή συζητήσεων με άλλες συνδεδεμένες εταιρείες εντός ΕΕ με σκοπό την άντληση γνώσεων για τη διαδικασία αυτή και την εξεύρεση συνεργειών.
A3-Έντυπο-συγκατάθεσης-κατόπιν ενημέρωσης-φιλικό-για-τον-ασθενή-Έκδοση 1.0
Συνημμένα
- Συμμετοχή ασθενών: Εμπειρογνώμων ασθενής στην εξωτερική Συμβουλευτική Επιτροπή Βιοηθικής
Μέγεθος: 898.102 bytes, Μορφή: .pdf
Ενημερωτικό γράφημα που περιγράφει μια έκθεση σχετικά με τη συμμετοχή ενός εμπειρογνώμονα ασθενή στην εξωτερική Συμβουλευτική Επιτροπή Βιοηθικής μιας φαρμακευτικής εταιρείας.


