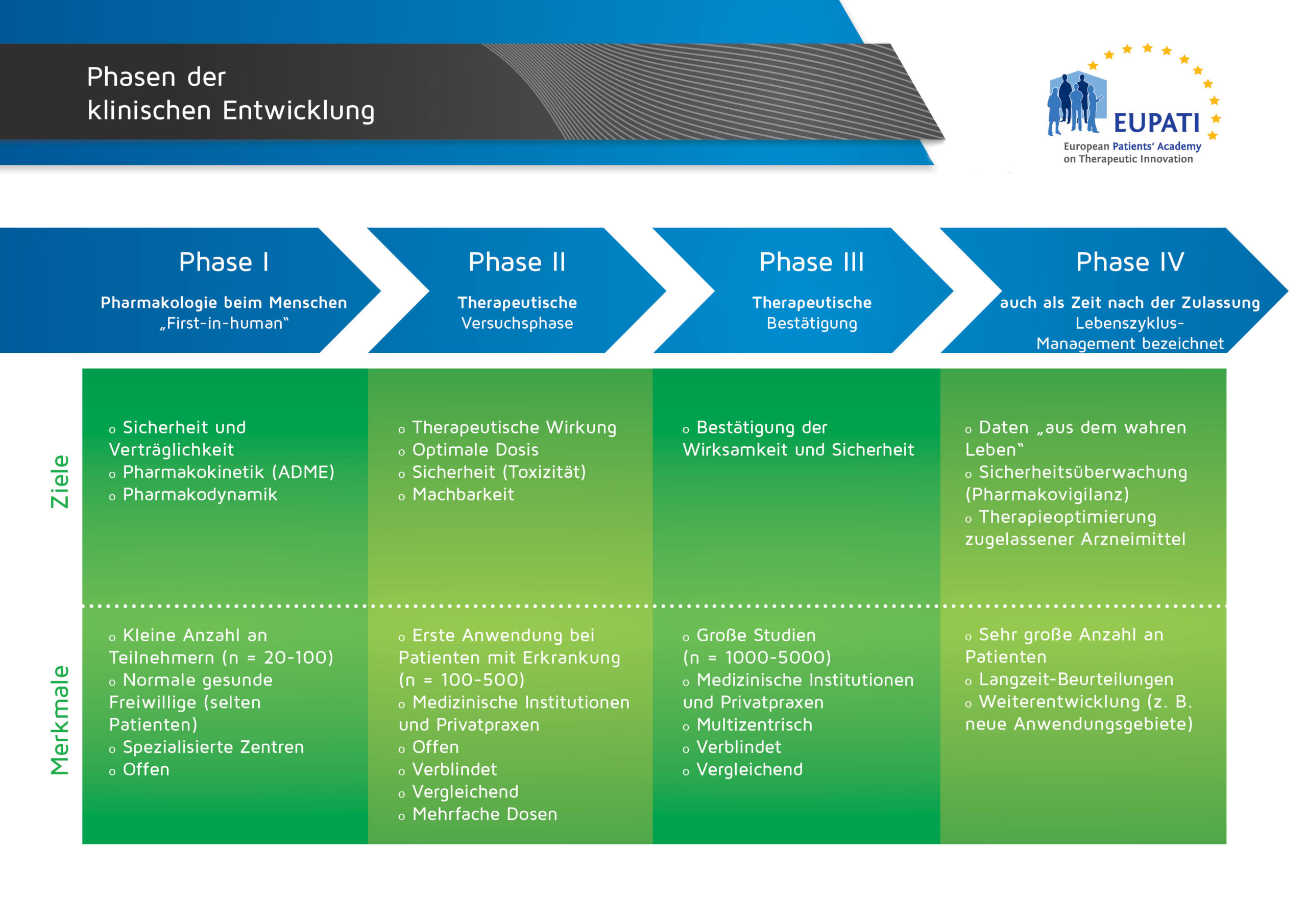
Phase-I-Studien
Die ersten Studien am Menschen mit einem neuen Arzneimittel sind für gewöhnlich Phase-I-Studien.
Phase-I-Studien werden in der Regel unter Teilnahme einer kleinen Anzahl gesunder freiwilliger Probanden durchgeführt (wobei für manche Studien auch Patienten rekrutiert werden). Das Ziel von Phase-I-Studien besteht darin, den sicheren Dosisbereich und jegliche Nebenwirkungen zu ermitteln. Die Anfangsdosis ist sehr niedrig und wird schrittweise erhöht, wenn keine oder nur leichte Nebenwirkungen beobachtet werden. Ein neues Arzneimittel muss bestimmte vorgegebene Anforderungen erfüllen, bevor es in Phase-II-Studien getestet werden kann. Phase-I-, Phase-II- und Phase-III-Studien werden gemeinsam als klinische Entwicklung bezeichnet.
#mla_gallery-1 { margin: auto; width: 100%; } #mla_gallery-1 .gallery-item { float: none; margin: 1.5%; display: inline-block; text-align: center; width: 97%; } #mla_gallery-1 .gallery-item .gallery-icon img { border: 2px solid #cfcfcf; } #mla_gallery-1 .gallery-caption { margin-left: 0; vertical-align: top; } /* see mla_gallery_shortcode() in media-library-assistant/includes/class-mla-shortcode-support.php */
- Die vier Phasen der klinischen Entwicklung unterscheiden sich in Bezug auf ihre Ziele und Merkmale.